INTRODUCCIÓN
La trisomía 21 (un cromosoma adicional en el par 21) es la alteración cromosómica más frecuente (OMIM#190685) y la principal causa de discapacidad intelectual [1]. Con una prevalencia estimada en torno a 1/700 recién nacidos, se está observando una importante reducción en los últimos años [2]. En la actualidad unas 35.000 personas en España y más de 6 millones en el mundo tienen síndrome de Down (SD) [3]. La vida de estas personas ha cambiado radicalmente en las últimas décadas, incrementándose su esperanza de vida de 25 a 60 años y mejorado igualmente la calidad, con buenos niveles de funcionalidad y autonomía individual; al abandonar las instituciones e integrarse en los colegios y en la comunidad [4-6]. Este aumento de las expectativas, precisa acompañarse de unos cuidados más especializados [5, 7].
El SD lleva el nombre del médico inglés que lo describió inicialmente (John Langdon Down) en 1866 y viene definido por un conjunto de síntomas y signos que aparecen de forma conjunta, conformando un patrón identificable. En 1959 los genetistas Jérôme Lejeune en Francia y Marthe Gautier en el Reino Unido, asociaron de forma incontrovertible el SD con la presencia de tres cromosomas 21, descartando a la sífilis como origen de la enfermedad. Los pacientes se caracterizan por presentar discapacidad cognitiva, hipotonía e hiporreflexia, hiperlaxitud articular, cara de apariencia peculiar… La importancia del área otorrinolaringológica (ORL) viene determinada por su implicación en el habla, la audición, la respiración y la deglución. Una encuesta de pacientes sobre el SD, revelaba que el 50% acudían regularmente a consulta de ORL [8]. La patología ORL que nos vamos a encontrar está condicionada por las variaciones estructurales del desarrollo craneal (especialmente del bloque medio-facial), por el déficit funcional del sistema inmunitario y por las alteraciones de la audición [7].
Los niños con SD tienen mayor predisposición de padecer patología otológica [9]. Este riesgo no se resume únicamente en una prevalencia más alta, sino en una edad de comienzo más precoz, un curso más prolongado y un mayor número de complicaciones, comparativamente al resto de la población [10]. La prevalencia de la hipoacusia congénita también es superior, así como la de aparición tardía [11]. Por tanto, los problemas auditivos, transitorios o permanentes, son más frecuentes, pudiendo mediatizar la evolución educativa y social, afectándose su calidad de vida [7].
El objetivo de este estudio ha consistido en analizar los resultados del seguimiento otológico y auditivo de los niños con SD que acudieron a nuestro Servicio de ORL del Hospital Clínico Universitario de Valladolid (HCUV), durante los últimos 29 años, poniendo especial énfasis en determinar la incidencia de hipoacusia “permanente” en esta población.
MATERIAL Y MÉTODO
Este trabajo ha sido aprobado por el Comité de Ética e Investigación del Área de Salud del HCUV (PI 22-2591). Se trata de un estudio longitudinal prospectivo/retrospectivo del seguimiento realizado en el Servicio ORL de un hospital de tercer nivel (HCUV) por uno de los autores, de 83 niños con SD que acudieron a consulta de hipoacusia infantil, desde el año 1993 al 2021 y de los datos introducidos tras una revisión actual de sus historiales.
Durante estos 29 años hemos ido almacenando, respetando la confidencialidad, en una base de datos Microsoft Access, la información de:
1-. Los niños evaluados con SD, que procedían del cribado auditivo, unos por ser “No Pasa” en las pruebas correspondientes y otros por estar incluidos en el grupo de riesgo de hipoacusia postnatal,
2-. Los procedentes de otras provincias, al ser nuestro Servicio, centro de referencia de hipoacusia infantil y
3-. Los que nos remitía la asociación de familias con SD de Valladolid (ASDOVA).
Los datos registrados, además de los demográficos generales incluían: fecha y edad de 1ª consulta, procedencia (Valladolid ciudad, provincia u otra ciudad), patología asociada general y otológica, pruebas audiológicas realizadas (impedanciometría, otoemisiones acústicas -OEA-, potenciales evocados auditivos tronco cerebral -PEATC-, de estado estable -PEAee-, audiometría conductual por refuerzo visual -ARV-, audiometría tonal liminal -ATL-) presencia de hipoacusia en función del oído (derecho, izquierdo o ambos), del tipo (neurosensorial -HNS-, transmisión o mixta), del grado (leve (20-40 dB), moderado (41-70 dB), severo (71-90 dB) y profundo (> 91 dB)), y de la evolución (estable, progresiva, fluctuante), adaptación de prótesis auditiva (edad y tipo), patología de oído medio (otitis media serosa -OMS-, otitis media aguda de repetición, otitis crónica simple, otitis colesteatomatosa), cirugías relacionadas (adenoidectomía, amigdalectomía, drenajes transtimpánicos -DTT-, miringo-osiculoplatia, cirugía del colesteatoma), años de seguimiento, resultado del cribado auditivo, fecha de última consulta y pérdida de seguimiento, con una ventana donde en cada paciente se referían un conjunto de observaciones específicas.
Población de estudio
Los datos generales se obtuvieron de los 83 niños que forman nuestra población global.
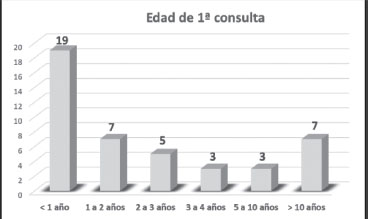
Para intentar determinar con mayor precisión la frecuencia y características de la hipoacusia permanente en los niños con SD, seleccionamos de este grupo global, a aquellos que tuvieran un periodo de seguimiento de al menos 5 años (44 niños), de los que 26 realizaron su primera visita con menos de 2 años. Hemos diferenciado en los resultados a estos 2 grupos (grupo general de 44 niños y subgrupo de 26 niños), para comparar la incidencia de la patología otológica y de la hipoacusia (Figura 1 y Tabla 1 -Anexo 1-).
RESULTADOS
El 63% de los niños estudiados con SD (N= 83) en el periodo comprendido entre 1993 y 2021, fueron varones, procedentes en el 88% de Valladolid y provincia. Al menos en 16 niños (19%), registramos su nacimiento en el HCUV, de los que un 25% (4/16) fue “No Pasa” en el cribado auditivo neonatal (con PEATC automáticos). Un 29% (24 niños) se perdió durante el seguimiento. El 77% eran menores de 5 años en la primera consulta y un 41%, con menos de un año. El 65% presentaba enfermedades asociadas (hipotiroidismo -42%-, alteraciones cardíacas -37%-, seguidas de patología ocular y músculo-esquelética).
Con el propósito de definir con mayor precisión la hipoacusia permanente, descartando los procesos intercurrentes y transitorios, las alteraciones auditivas sólo se valoraron en aquellos niños con SD que hubieran sido revisados en consulta durante al menos 5 años (44 niños, cuya edad media al finalizar el seguimiento era de 20,4 años). El 59% de esta muestra se empezó a evaluar con <2 años (26/44, cuya edad media al final del seguimiento era de 14,9 años); el 25% entre 2 y 10 años (11/44) y un 16% con más edad (7/44)) (Figura 1). Al 46% de la población la hemos seguido durante más de 10 años y al 43% entre 1 y 10 años.
Detectamos un 66% de malformaciones de oído externo. La patología de oído medio estuvo presente en el 93%, destacando la OMS (Tabla 1 -Anexo 1-).
Realizamos pruebas auditivas al 93%, diagnosticando la presencia de hipoacusia en el 61% de los niños, que fue bilateral en el 78% de los afectados (la incidencia global de hipoacusia bilateral en los niños con SD es del 48% y del 13,6% la unilateral). El 87% de las hipoacusias detectadas, son de grado leve/moderado y el 6% de grado profundo. La incidencia de la hipoacusia leve en los niños con SD es del 26%, del 21% para la moderada y del 6,8% para la severa/profunda (Tabla 1 -Anexo 1-). La edad de detección de la hipoacusia se muestra en la Figura 2, donde cabe destacar que el 53% de los menores de 5 años tiene hipoacusia permanente.
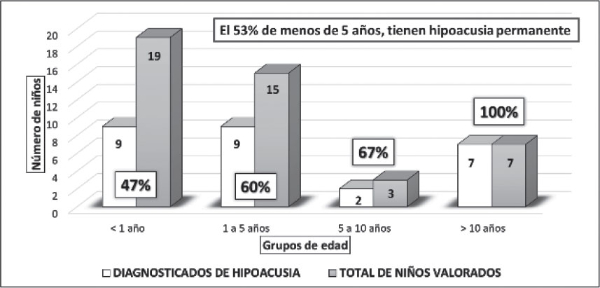
Figura 2. Porcentaje de niños diagnosticados con hipoacusia “permanente” (n=27) en los diferentes rangos de edad. Seguimiento ≥ 5 años (n= 44).
El tipo de hipoacusia más frecuente fue la mixta (48% de todas las hipoacusias), seguida por la HNS (35%). La incidencia de la hipoacusia mixta en la población estudiada de niños con SD es del 26%, HNS (19%) y transmisión (9%) (Tabla 1 -Anexo 1-). El 88% de las hipoacusias de transmisión son de carácter leve, el 83% de las mixtas son de grado leve/moderado y el 53% de las HNS son también leves (aunque 2 de las 3 hipoacusias profundas son HNS). Las 6 hipoacusias unilaterales detectadas, son de carácter leve/moderado.
La adaptación protésica con audífonos se llevó a cabo en el 48% de los niños con hipoacusia (13/27); recibiendo un 11% una prótesis osteointegrada (3/27) y un 4% un IC (1/27) (Tabla 1 -Anexo 1-).
De los 4 niños que fueron “No Pasa” en el cribado auditivo, 2 presentaban audición normal y el motivo del “No Pasa” era una OMS; uno mostraba una hipoacusia leve de un lado, con adaptación protésica actual; y al cuarto niño, con factores de riesgo neonatales de hipoacusia, le diagnosticamos una hipoacusia profunda bilateral, adaptándole un implante coclear en cada oído, al año y medio de edad. Es decir, la incidencia de hipoacusia congénita es del 12,5%.
Se realizó cirugía ORL al 62%, destacando en frecuencia, la adenoidectomía y la colocación de DTT, con una tasa de reintervención en ambos casos, de alrededor del 25% (Tabla 1 -Anexo 1-). La incidencia de colesteatoma fue del 6,8% y los 3 pacientes fueron intervenidos quirúrgicamente.
DISCUSIÓN
Cada persona con SD es única, de modo que tanto sus potencialidades como sus problemas, abarcan un espectro muy amplio y muy distinto de unos individuos a otros [7].
Dada la enorme frecuencia de patología otológica (93%) y auditiva (61%) que hemos detectado en esta población, consideramos absolutamente necesario el seguimiento ORL, para evitar, en lo posible, las repercusiones añadidas en su desarrollo general y condiciones de vida.
La literatura indica que la hipoacusia temporal causada por OMS, puede llegar a afectar al 93% de los niños con SD al año de edad (de acuerdo con nuestros resultados) y al 68% a los 5 años [12], motivo por el que, coincidiendo con otros autores [6], hemos considerado que este periodo de al menos 5 años, era un tiempo suficiente, para poder conocer con mayor precisión el estado auditivo “definitivo” del niño, libre de sus procesos de oído medio. Pero a la mayor parte de estos niños les hemos seguido durante mucho más tiempo (media de edad al finalizar el estudio de 20,4 años) lo que nos ha permitido realizar pruebas auditivas objetivas y de comportamiento, ARV y ATL, pudiendo disponer de resultados audiométricos fiables de una posible hipoacusia permanente.
Si comparamos los resultados (Tabla 1 -Anexo 1-) del grupo general de 44 niños con el subgrupo de 26, cuya primera visita se realizó con menos de 2 años, vemos que son muy parecidos. Sólo destaca la incidencia de OMS y de OMA de repetición en el grupo evaluado precozmente, lo que confirma la mayor prevalencia de esta patología en los 2 primeros años de edad.
Como a continuación explicaremos, el seguimiento periódico, clínico y audiológico, del niño con SD, representa un reto para el ORL y la familia. Pero resulta aún más difícil, saber escoger las mejores opciones terapéuticas, especialmente durante los primeros años de vida [13].
La exploración de los oídos de un niño con SD es compleja, a través de un conducto que suele ser muy estrecho, en más del 50% de nuestros pacientes, ocupado por cera y donde la quietud necesaria para realizar una otomicroscopia es habitualmente muy difícil [6, 14-15]. Aun estando de acuerdo con la periodicidad, que las guías nacionales e internacionales, determinan para las revisiones auditivas, en función de la edad [7, 16], no suelen servir en estos primeros años, porque la reiteración de la OMS es tan elevada, que obliga a revisiones más frecuentes.
Por otra parte, resulta complicado medir la audición de un niño SD con las pruebas electrofisiológicas objetivas, pues la discapacidad intelectual y la morbilidad añadida, ponen al límite la paciencia y el buen hacer del personal encargado. Además, las frecuentes fluctuaciones asociadas a la patología recurrente del oído medio, conllevan la necesidad de realizar pruebas auditivas más frecuentes. Aunque los equipos automatizados de OEA y PEATC son de gran ayuda, no permiten obtener todo el perfil auditivo y en ocasiones, la pérdida supera su capacidad de detección, debiendo acudir a los PEATC o PEAee convencionales, donde a partir de los 6-9 meses de edad, el sueño natural o la sedación superficial no suelen ser efectivos, precisándose una sedación anestésica. La ARV puede ser una alternativa, pero dependiendo del niño, también plantea mayores dificultades (respuestas inconsistentes y escasa atención).
Con todo, lo más difícil es la toma de decisiones, especialmente en lo que respecta a la OMS, por sí misma y por su influencia sobre la audición. Las tres opciones para tratar la hipoacusia en caso de OMS son: la colocación de DTT, la adaptación de una prótesis auditiva o “esperar y ver”. No se conoce la eficacia relativa de estos procedimientos, de manera que la alternativa depende de la experiencia del profesional implicado y de su punto de mira: el oído y su audición o, la salud “en general”, su desarrollo y la vida en familia [17]. Ante las dificultades que implica la colocación de DTT en edad temprana, por la frecuente estrechez del CAE y unos resultados peores que en el resto, debido a complicaciones supurativas, facilidad de extrusión y recidiva; debiéndose añadir las anestésicas y el riesgo de subluxación atlo-axoidea [5, 18-20], nosotros hemos preferido adoptar una conducta conservadora [18, 21-22], frente a un tratamiento más agresivo [6, 23]. Nuestra actitud se basa en determinar, caso por caso, la conveniencia quirúrgica. Después de explicar a la familia los pros y contras, evaluamos las dificultades auditivas durante un periodo de tiempo y dentro de un contexto, evitando que la decisión provenga de una medida concreta de audición que, aun teniéndola en cuenta, no refleja seguramente las fluctuaciones que el niño experimenta [12]. Las alteraciones timpánicas, la OMA de repetición y fundamentalmente la discapacidad auditiva que la familia y los cuidadores perciben dentro de su entorno, determinarán la prioridad de nuestras decisiones. En casos más severos o en quienes no son candidatos a cirugía o ante el rechazo de ésta por los padres, hemos optado, en ocasiones, por la colocación de una prótesis auditiva que, aun suponiéndoles un hándicap, es una excelente recomendación para alcanzar unos niveles auditivos suficientes [13]. Su adaptación presenta dificultades intrínsecas dependientes del tamaño del CAE y de la presencia de cera; son, en general, mal aceptados, porque les molesta, posiblemente también por las fluctuaciones auditivas que les generan y por problemas de mantenimiento más frecuentes, lo que finalmente determina que su utilidad sólo sea posible en algunos. Otra alternativa podrían ser las prótesis auditivas de vía ósea y en aquellos ambientes donde el niño pasa más tiempo, la instalación de altavoces que permitieran amplificar la voz del cuidador. Finalmente, en un 41% de los niños, hemos considerado la conveniencia de DTT, teniendo que reintervenir en 2 o más ocasiones al 28%, valores que en la literatura alcanzan hasta un 63% [21, 23]. Pero también, las complicaciones timpánicas tras la colocación de DTT son más frecuentes en el SD y aún más, en casos de reintervención, provocando en alguno de nuestros pacientes una perforación residual, que con cierta frecuencia evoluciona a una otitis media crónica, con otorrea recurrente [21, 23]. Resulta por tanto muy difícil delimitar el margen de actuación, porque al no disponer de otros indicadores, desconocemos la evolución posterior de cada niño en concreto. Así que, consideramos fundamental seguir investigando, para poder llegar a determinar, qué es lo que funciona, para quién, bajo qué circunstancias y cómo [17].
Para los padres también es un reto y a pesar de explicarles la importancia del seguimiento ORL posterior al cribado auditivo neonatal (con independencia del resultado), terminan cansados o les resulta incompatible mantener este régimen de visitas, a nuestro Servicio y a otros [24]. Y con el convencimiento subjetivo de que aparentemente el niño está bien, por las respuestas auditivas que obtienen, hay un elevado porcentaje de pérdidas en el seguimiento (29% en nuestro estudio), frecuentes por otra parte, en los programas de salud [25-26]. En ocasiones vuelven al cabo de unos años, pero al perderse la continuidad, desconocemos la evolución de lo que haya ido sucediendo. Creemos que, en este caso, como en otros, la participación de equipos experimentados en el niño con SD, y transdisciplinarios, coordinados entre sí y con atención primaria, podrían, con la colaboración familiar, solventar muchas dificultades y facilitar el tránsito entre la medicina primaria y la hospitalaria. La programación debería ofrecer una atención flexible y personalizada, con unos servicios de intervención temprana centrados en el niño y en su familia [5, 27].
La incidencia de hipoacusia en el SD es mayor que en el resto de la población y representa un factor de riesgo de primer nivel. Cuando realizamos una comparación de las cifras publicadas con las obtenidas en nuestro seguimiento, llama la atención la disparidad de resultados, que en gran parte se debe a que se estudian diferentes muestras de población, de distintas edades y con procedimientos metodológicos dispares [11]. De acuerdo con la CDC, más del 75% de los niños con SD están afectados de hipoacusia [2]. Como en otros estudios [23, 28-30] el 84% de nuestra población ha tenido OMS, generando una hipoacusia temporal, que contrasta con el 20% de prevalencia de OMS a los 2 años de edad, en el resto de población [31]. Hacia los 6-8 años, al mejorar la función de la trompa de Eustaquio y disminuir la frecuencia de catarros, la incidencia de OMS desciende, aunque en el SD esta evolución es mucho más lenta, lo que suele sorprender y preocupar a los padres [23]. Pero en general, a partir de esta edad podemos diagnosticar o reevaluar, en la mayoría de los pacientes, la presencia de una hipoacusia residual “permanente”, si no ha sido posible hacerlo previamente [23, 30].
En los resultados presentados hemos intentado determinar, con la precisión que nos ofrece un rastreo tan prolongado, el porcentaje de hipoacusias permanentes (61%), es decir, descartando la existencia de un derrame de oído medio (Tabla 1 -Anexo 1-). El seguimiento durante más de 10 años del 81% de los niños con hipoacusia (22/27), y de 5 a 10 años en el resto, aporta esta seguridad en gran parte de los casos. El porcentaje de hipoacusia bilateral (78%) y unilateral (22%), coincide con los datos de Nightengale et al. (2017) [11]. Por otra parte, dado que el grado y tipo de hipoacusia puede ser diferente en cada uno de los dos oídos del mismo individuo, hemos preferido describir el porcentaje de oídos afectos en relación al total de oídos estudiados (a cuyo diagnóstico final hemos llegado comparando el resultado de las pruebas electrofisiológicas objetivas -OEA, PEATC, PEAee- con el de las subjetivas, a través de la ARV, empleada en el 61% de los niños (27/44) y de la ATL aplicada al 73% (32/44)). Quizá por estas razones, tenemos tan pocas hipoacusias de transmisión (9%) en relación a los valores de prevalencia registrados en la literatura, que oscilan entre el 38% y el 78% [26, 30]. Pero aun siendo inferior al publicado, nuestro porcentaje de hipoacusia de transmisión es muy elevado respecto al resto de la población y suponemos que, exceptuando los residuos/secuelas de oído medio y las otitis crónicas supuradas, haya probablemente un conjunto de hipoacusias estructurales y permanentes, secundarias a la presencia de tejido mesenquimal en el oído medio (referido en el 75%) o a malformaciones en la cadena osicular (25%), que no hemos podido comprobar [26, 32-35]. Por su parte, la HNS está presente de forma aislada, en el 19% de los oídos evaluados, constituyendo el 35% de las hipoacusias encontradas (similar a [11]), siendo de grado profundo en el 3,4% de los oídos examinados. No obstante, el 26% de los oídos estudiados tiene una hipoacusia mixta, lo que conlleva un cierto componente neurosensorial que, teniéndolo en cuenta, daría una incidencia de HNS, del 45%. La prevalencia de HNS en el niño con SD, muestra en la literatura valores muy variables que oscilan del 4% al 55% [6, 11-13], y que como en el resto, puede tener un origen genético o adquirido, manifestándose desde el nacimiento (congénito) o tardíamente y afirmándose que suele ser progresiva [12]. En los casos verificables de nuestros resultados, hemos encontrado esta progresión en el 68% de las hipoacusias mixtas (11/16) y en el 31% de las HNS (4/13). Como posibles causas de HNS, se han descrito diferentes alteraciones asociadas, como el acortamiento del órgano de Corti, la disminución de células en el ganglio espiral y anomalías de oído interno, como la displasia de Mondini [32-33, 36]. El estudio de TC desvela un estrechamiento del conducto auditivo interno (25% de casos) y malformaciones de la región vestibular en el 75% de niños con SD [37].
Nuestro porcentaje de “No Pasa” cribado auditivo con PEATC-A (25%) es similar al publicado en la literatura, que varía del 26 al 36% [11, 23, 26], contrastando con el de la población general (0,32%) [38]. Aunque se trata de una pequeña muestra, la incidencia registrada de hipoacusia congénita (12,5%) también es parecida a la de otros [11, 39] y muy superior a la de la población general (0,3%) [38].
El recuento de la cirugía practicada a los niños con SD, en un centro infantil especializado de Birmingham (UK), indicaba que los procedimientos ORL fueron los más frecuentes, seguidos por la cirugía cardíaca y la pediátrica general [5]. El porcentaje de niños a los que realizamos cirugía ORL fue del 59%, superior a algunas publicaciones [28]. La cirugía de DTT (41%), tiene valores variables en la literatura: 14%-88% [6, 23, 26, 39]. También hubo un gran porcentaje de adenoidectomías (52%), en su mayor parte (69%) asociada a la cirugía de DTT [18]. Dada la propensión a padecer OMS recurrente y como consecuencia de la repetida colocación de DTT, hay también un incremento de perforaciones permanentes, bolsas de retracción y colesteatomas. El porcentaje de colesteatomas que hemos diagnosticado y tratado (6,8%) es similar al descrito en la literatura [18, 21, 40].
CONCLUSIONES
Habida cuenta del gran porcentaje de niños con SD afectos de patología otológica y auditiva, consideramos fundamental el seguimiento ORL especializado y la conveniencia de transmitir a los médicos de atención primaria, padres, profesores y logopedas, la importancia de identificar tempranamente la pérdida de audición.