Abreviaturas
CVD, enfermedad cardiovascular
DMT2, diabetes mellitus tipo 2
IDR, ingestas dietéticas de referencia
OMS, Organización Mundial de la Salud
PA, proantocianidinas
Introducción
Entre los componentes de los alimentos que mayor interés han despertado en las últimas décadas se encuentra la fibra dietética(1-3). Convencionalmente, en los textos clásicos de nutrición no se incluía como nutriente ya que se consideraba que no se absorbía, y por tanto, que no aportaba energía, no obstante, en la actualidad, se conoce que su consumo tiene efectos beneficiosos en el consumidor, siendo bien conocidos los efectos sobre marcadores de riesgo de enfermedades degenerativas como cardiovasculares, obesidad, diabetes o cáncer(16). Uno de los aspectos más novedosos es el papel de la fibra dietética a nivel digestivo e intestinal, ya que algunos tipos de fibras dietéticas modulan multitud de funciones del sistema digestivo, tales como el mantenimiento de una integridad y funcionalidad adecuada de la mucosa, fundamentalmente colónica. Además, su fermentabilidad, contribuye al aporte energético global de la dieta, y permite mantener toda la diversidad y funcionalidad de la microbiota intestinal, siendo esta la responsable de crear un entorno óptimo para facilitar la entrada de nutrientes y la eliminación selectiva de residuos y microorganismos patógenos(3, 6, 7) .
Fibra dietética
En el año 2001, la American Association of Cereal Chemists la definió como: “la parte comestible de las plantas o análogos de hidratos de carbono que son resistentes a la digestión y a la absorción en el intestino delgado, con completa o parcial fermentación en el intestino grueso. Incluye polisacáridos, oligosacáridos, lignina y sustancias asociadas de las plantas(8). Más tarde, el Codex Alimentarius(9) indica que la decisión sobre si se deben incluir o no los hidratos de carbono con tres a nueve unidades monoméricas en el término de fibra dietética, debe recaer en las autoridades competentes de cada país.
La fibra dietética, está integrada por multitud de componentes (Tabla 1), por ello no puede considerarse una identidad química con funciones bien delimitadas. La clasificación de la fibra suele realizarse atendiendo a sus propiedades más importantes, así como, según su:
Tabla 1. Clasificación de la fibra dietética y su relación con los tipos de hidratos de carbono y sustancias asociadas, tipos de hidratos de carbono y compuestos asociados
| HIDRATOS DE CARBONO | SUSTANCIAS ASOCIADAS | ||||||
|---|---|---|---|---|---|---|---|
| FIBRA SOLUBLE | FIBRA INSOLUBLE | ||||||
| FIBRA FERMENTABLE | FIBRA POCO FERMENTABLE | ||||||
| Oligosacáridos (prebióticos) | Polisacáridos amiláceos | Polisacáridos no amiláceos solubles | Polisacáridos no amiláceos insolubles | Cutina Fitatos Lignina Proteína Taninos Ca2+, Na+, Mg2+ |
|||
| FOS GOS | Almidón resistente | β-glucanos Gomas Hemicelulosa Mucílagos Pectinas |
Celulosas Hemicelulosas | ||||
FOS, fructooligosacaridos; GOS, galactooligosacaridos. Modificada de Ruiz-Roso(10).
- “Solubilidad en medios hidroalcohólicos"
- “Grado de hidratación"
- “Capacidad formadora de geles"
- “Capacidad de incrementar la viscosidad del medio"
- “Capacidad de ser fermentada por bacterias colónicas"
- “Estructura química"
Una de las propiedades más importantes de muchas fibras dietéticas clasificadas como “solubles", es su capacidad de generar “soluciones de gran viscosidad", o también conocida como “capacidad gelificante". Estas propiedades determinan el vaciamiento gástrico y el tiempo de tránsito en el intestino. La ralentización del vaciamiento gástrico conduce a la “sensación de saciedad", e influye de manera significativa sobre la glucemia y lipemia postprandial, así como sobre los niveles de colesterol plasmáticos(1). Además estas fibras son fácilmente “fermentadas por la microbiota intestinal", lo que produce un aumento de la población microbiana, contribuyendo, a su vez al tamaño de la masa fecal(1,6,7,9).
Por su parte, aquellas fibras clasificadas como “insolubles" presentan menor capacidad de formar soluciones viscosas, aunque algunas de ellas tienen gran capacidad de “retener agua en los tramos finales del intestino", lo que influye de manera determinante sobre “el peso y el volumen fecal". Además, estas suelen ser muy poco fermentables, y ello determina que la masa fecal tenga un mayor contenido de residuo(1,10).
Fibra dietética y microbiota intestinal
Para entender la relación que existe entre el consumo de fibra dietética y la microbiota intestinal, es necesario comprender qué es la fermentabilidad de la fibra. Dado que esta no es hidrolizada por los enzimas digestivos, posteriormente es fermentada, en el colon fundamentalmente gracias a la actividad de las bacterias colónicas. Como consecuencia, estas liberan hexosas, pentosas y alcoholes, productos que al no ser absorbibles en el intestino grueso, siguen siendo degradados por estas poblaciones bacterianas, liberándose otros productos como hidrógeno, metano, dióxido de carbono, ácido láctico, ácidos grasos de cadena corta, entre los que cabe destacar acético, propiónico y butírico entre otros, y a energía que es aprovechada por las mismas bacterias(6,7,11). Como consecuencia, la “fermentabilidad" de la fibra dietética, condiciona dos aspectos importantes para el ser humano: por un lado su efecto prebiótico, ya que favorece la proliferación de poblaciones bacterianas colónicas beneficiosas, y por otro lado la liberación de metabolitos activos con efecto positivo (1,3,6,7,11).
En la última década, la microbiota intestinal ha despertado vivo interés. Está constituida por levaduras, virus, hongos, protozoos, bacteriófagos, pero principalmente por bacterias. Es por ello, por lo que los efectos más conocidos de la microbiota intestinal siempre se refieren a estas últimas (3,6,7).
Tal y como se manifiesta en estudios recientemente publicados, se conoce que el microbioma intestinal de individuos sanos se asocia con una mayor diversidad microbiana con respecto al de personas con patologías(12). Cuando se habla de diversidad microbiana, se hace referencia a dos aspectos: por un lado al número diferente de las especies y por otro a la abundancia general de cada especie microbiana(13). Simpson y Campbell(14) han observado que, un consumo adecuado de fibra dietética afecta significativamente a la composición de la microbiota intestinal. Además un elevado consumo de fibra dietética, se asocia con una mayor estabilidad, abundancia y pluralidad de la microbiota intestinal(6,7,15); mientras que se asocia un bajo consumo de fibra dietética con desequilibrios marcados en el microbioma intestinal, también conocidos como “disbiosis". Estos desequilibrios pueden conducir a problemas serios de salud(6,7,12) , ya que pueden originar procesos inflamatorios que se relacionan con el desarrollo de muchas enfermedades infecciosas, asma, alergia, obesidad, síndrome metabólico, enfermedad inflamatoria intestinal, diabetes, enfermedades hepáticas y cáncer de colon(1,3).
Adicionalmente, la distribución microbiana parece estar claramente relacionada con aspectos Nutriciónales. Así, se ha observado que aquellas personas que consumen cantidades adecuadas de fibra dietética, su microbiota intestinal se asemeja en mayor medida a la de personas adultas sanas; y que por el contrario, en aquellas personas cuya ingesta de fibra es inferior a la cantidad recomendada o adecuada, la microbiota intestinal, se asemeja a la de personas afectadas de carcinomas, adenomas, enfermedades inflamatorias intestinales, obesidad, etc.(12).
Se consideran bacterias beneficiosas para el ser humano aquellas cuya función mejora el desarrollo intestinal, así como la digestibilidad, la inmunidad o la resistencia a infección por patógenos entéricos(3). Numerosos estudios destacan el papel que tienen las bacterias intestinales a la hora de modular actividades fisiológicas importantes, como funciones digestivas normales del huésped, maduración del sistema inmune con capacidad defensiva contra microorganismos patógenos, homeostasis intestinal (3,14-16) y funciones biológicas vitales en el cuerpo humano, como la funcionalidad cerebral, la traducción de ARNm, la producción de ATP o la metabolización de la glucosa(12).
Hoy en día, no se conocen al completo las rutas por las que la microbiota induce a estos efectos, por lo que se sugieren entre otras: a) el aumento de la colonización de aquellas bacterias favorables en el intestino grueso capaces de competir con microorganismos patógenos; b) la producción de energía a partir de la fermentación de la fibra, utilizable por las células de la pared intestinal; c) la producción de ácidos grasos de cadena corta; d) el aumento de volumen de las heces; e) la modulación de la velocidad de tránsito intestinal; f) la modulación del sistema inmune; g) la expresión génica y h) la diferenciación celular en la pared intestinal (3).
La variabilidad interindividual unida a la variedad de las dietas utilizadas en muchos estudios hace que no puedan emitirse conclusiones determinantes a cerca de las propiedades de la microbiota intestinal. No obstante, existe evidencia creciente de las diferencias de aquellos géneros bacterianos predominantes en el intestino de individuos sanos y en el de enfermos, así como los diferentes factores endógenos y exógenos, que favorecen o inhiben su desarrollo, variedad y grado de disbiosis.
Es comúnmente aceptado que el microbioma intestinal de los individuos sanos cuenta con cientos de especies bacterianas, y aunque existen diferencias interindividuales importantes(6,14), se han identificado cuatro filos dominantes: Bacteroidetes, Firmicutes, Actinobacteria y Proteobacteria(6,7,12). Más del 90% de las bacterias intestinales de personas sanas, pertenecen a los filos Bacteroidetes y Firmicutes, razón por lo que normalmente las bacterias pertenecientes a estos filos se relacionan con “signo de salud"(14). El microbioma intestinal de individuos sanos se asocia con una mayor proporción de Bacteroidetes frente a Firmicutes, mientras que esta relación es inversa en el microbioma de individuos obesos(12). Varias revisiones coinciden en que los géneros bacterianos más abundantes en el microbioma intestinal son Bacteroides, Prevotella, Bifidobacterium, Lactobacillus, Ruminococcus, Caprococcus, Dorea, entre otros(12,14,15).
Se ha demostrado que un mayor consumo de fibra fermentable, potencia la presencia de bacterias del género Bifidobacterium, lo que se considera beneficioso, debido al papel antinflamatorio que estas poseen(14). Este género pertenece al filo bacteriano Actinobacteria. Otros autores confirmaron la asociación entre un mayor consumo de fibra procedente de legumbres, y la mayor abundancia de este filo a nivel intestinal(16). Además una mayor ingesta de fibra dietética se ha asociado con una mayor abundancia de algunos géneros de la clase Clostridia (filo Firmicutes), como Lachnospira, Faecalibacterium y SMB53(16). Estos autores recalcan el papel fisiológico beneficioso que juegan algunos géneros de la clase Clostridia debido a los metabolitos resultantes de la fermentación de la fibra y a su papel ventajoso para los colonocitos. También cabe destacar la asociación que se ha observado entre un mayor consumo de fibra y la mayor abundancia de Faecalibacterium prausnitzii, especie con importante papel en la producción de algunas interleuquinas (p.ej. IL-10), que se han asociado con actividad antiinflamatoria(16). Además, se ha sugerido un mayor riesgo de padecer enfermedades intestinales como la enfermedad de Crohn o cáncer colorectal en aquellos pacientes que muestran una reducción de estas especies(16).
Por otro lado, elevadas ingestas de fibra se han asociado con la reducción de la presencia de otros géneros bacterianos como Actinomyces y Odoribacter(16). Muestras de intestino humano procedente de colonoscopias de individuos con cáncer colorectal, mostraron una mayor prevalencia del género Odoribacter respecto a individuos sanos(16). De forma similar también se encontró incremento en la abundancia del género Actinomyces en muestras fecales de sujetos con cáncer colorectal(16). Además, numerosos estudios sugieren que aquellas dietas caracterizadas por un bajo contenido de fibra resultan en una mayor prevalencia de disbiosis con un aumento de bacterias pertenecientes al filo Proteobacteria(17). Dentro de este, se incluyen bacterias patógenas, asociadas a la mucosa, invasivas adherentes como Escherichia coli(14).
Ingestas dietéticas de referencia de fibra dietética
Dada la importancia que tiene el consumo de fibra dietética, las autoridades sanitarias se han visto obligadas a establecer unas ingestas dietéticas de referencia (IDR), para que la población se ajuste a ellas. De tal modo, tanto a nivel mundial, europeo, como español, se establece que se deberían consumir al menos 25 gramos diarios de fibra dietética (Tabla 2).
Tabla 2. Ingestas dietéticas de referencia a nivel mundial y europeo para adultos.
| AUTORIDAD | IDR | EFECTO |
|---|---|---|
| EFSA, Panel Científico NDA | 25 g/día | Laxación normal |
| EFSA, Panel Científico NDA | >25 g/día | Reduce riesgo padecer CVD, DMT2 Mejora mantenimiento peso |
| OMS, FAO/OMS | >25 g/día |
EFSA: European Food Safety Authority; NDA, Panel científico de Productos Dietéticos, Nutrición y Alergias de la EFSA; CVD,Enfermedades cardiovasculares; DMT2, Diabetes mellitus tipo 2; OMS, Organización Mundial de la Salud; FAO, Organización de las Naciones Unidas para la Alimentación y la Agricultura.
La Comisión Europea solicitó una opinión al Panel científico de Productos Dietéticos, Nutrición y Alergias sobre las IDR de fibra dietética para la población europea. Este establece que 25 gramos diarios son adecuados en adultos para una normal laxación, y afirma que cantidades superiores reducen el riesgo de padecer enfermedades coronarias, diabetes mellitus tipo 2 (DMT2), y mejoran el mantenimiento del peso corporal adecuado(18,19). De la misma manera la OMS, recomienda la ingesta de las mismas cantidades de esta en el año 2003, opinión que volvió a ser respaldada más tarde en el 2007 por la Actualización Científica FAO/OMS(18) .
A nivel nacional, los Objetivos Nutriciónales (ON) finales marcados fueron: ˃14 gramos de fibra por cada 1.000 kcal ingeridas, lo que se corresponde con ˃25 gramos de fibra/día en mujeres y ˃35 gramos/día de fibra en hombres(20) (Tabla 3).
Tabla 3. Objetivo Nutriciónal español.
| AUTORIDAD | OBJETIVO NutriciónAL | EFECTO |
|---|---|---|
| SENC | >14 g/1.000 kcal = >25 g/día mujeres >35 g/día hombres |
Crecimiento normal Correcta laxación |
SENC: Sociedad Española de Nutrición Comunitaria. Adaptado de Arija et al.(20)
La evidencia científica para establecer las IDR en niños es más limitada, por ello se considera que el consumo de fibra dietética debería basarse en las IDR de los adultos relativizándolas a la ingesta de energía. Así se establece que una ingesta de 2 gramos de fibra/MJ de la energía total ingerida propicia un crecimiento y desarrollo normal del niño, además de ser una cantidad adecuada para la correcta laxación(18) (Tabla 4).
Tabla 4. Ingesta dietética de referencia europea para niños entre 1 y 17 años.
| AUTORIDAD | IDR | EFECTO | EDAD | g/día |
|---|---|---|---|---|
| EFSA | 2 g/MJ energía = 8,4 g/1.000 kcal | Normal crecimiento Correcta laxación | De 1 a 3 años | 10 |
| De 4 a 6 años | 14 | |||
| De 7 a 10 años | 16 | |||
| De 11 a 14 años | 19 |
Adaptada de European Food Safety Autority(18). MJ, Megajulio; IDR, Ingesta Dietética de Referencia
Consumo actual de fibra dietética
Conociendo la importancia que tiene un consumo adecuado de fibra dietética, y la cantidad necesaria a ingerir para poder aprovechar estos beneficios, se ha procedido a la investigación de cuál está siendo realmente el consumo de fibra por parte de la población. En el año 2010, EFSA(18) realizó encuestas individuales de consumo a destinos países de la UE, resumiéndose en la Tabla 5 los resultados obtenidos.
Tabla 5. Consumo de fibra dietética en Europa y en España en distintos grupos de población.
| EDAD (AÑOS) | INGESTA DE FIBRA | IDR | ¿SE ADECUA? |
|---|---|---|---|
| Europa | |||
| 1-3 | >10 g/día | >10 g/día | SÍ |
| 4-10 | 14-16 g/día | 14-16 g/día | SÍ |
| 11-19 | </>19-21 g/día. | 19-21 g/día. | EN ALGUNOS PAÍSES |
| 19-34 | <25 g/día | 25 g/día | NO |
| 34-65 | <25 g/día | 25 g/día | NO |
| España | |||
| 10-14 | Niños 18,5 g/día Niñas 17,5 g/día |
19 g/día | NO |
| 15-18 | Niños 18,9 g/día Niñas 16,2 g/día |
21 g/día | NO |
| 19-64 | Hombres 19,2 g/día Mujeres 16,9 g/día |
25 g/día | NO |
Fuente. EFSA(18). IDR, Ingestas dietéticas de referencia.
A nivel europeo sólo aquellas personas entre 1 y 10 años de edad, ajustan su ingesta de fibra dietética a las ingestas recomendadas, en la mayoría de los países estudiados. De 11 a 19 años de edad, la mitad de los países estudiados tienen un consumo inferior al que se recomienda, y a partir de los 19 años, sólo Alemania, Noruega y Polonia igualan o superan las ingestas recomendadas, y el resto de los países tienen un consumo muy inferior al recomendado(18).
La ingesta de fibra dietética de la población española es bastante inferior a la recomendada por los Objetivos Nutriciónales. Ninguno de los grupos de población estudiados alcanza la cantidad recomendada, y además se observa que los valores de consumo se alejan de las recomendaciones de manera proporcional al aumento de edad(20).
Estrategia para alcanzar las Ingestas Dietéticas de Referencia
Debido a la baja ingesta de este nutriente por parte de la población, se plantea la necesidad de incrementar su consumo. Entre las estrategias planteadas, se encuentra el cambio de hábitos de consumo de la población, no obstante, dado que se trata de una tarea difícil, surge la necesidad de recurrir a otras estrategias, como la de incluir fibra dietética como ingrediente en alimentos de consumo habitual en la población. De tal modo se generan, los conocidos como nuevos alimentos funcionales. Actualmente se ha trabajado en la incorporación de fibra dietética procedente de extracto de algarroba, rico en proantocianidinas, en matrices cárnicas. Algo que está resultando en efectos positivos en el perfil lipoproteico, en la oxidación de las lipoproteínas de muy baja densidad (VLDL), y en los receptores de las lipoproteínas de baja densidad (LDL) inducidos por dietas aterogénicas en ratas; así como resulta en efectos positivos en la señalización de insulina en ratas diabéticas, tiene efectos en la digestión de grasa y por tanto, en la lipemia postprandial en ratas sanas, así como en el decrecimiento de la absorción de hidratos de carbono, o ha demostrado poseer efectos antioxidantes(21-25), entre otros efectos (Tabla 6). Dado el debate que surge actualmente referente al consumo de productos cárnicos(26), se buscan otros alimentos susceptibles de incorporación de fibra dietética, con los que se podría comenzar a experimentar.
Tabla 6. Efectos metabólicos beneficiosos sistémicos y gastrointestinales derivados del consumo de proantocianidinas.
| Efecto en el metabolismo de hidratos de carbono | Efectos en el metabolismo lipídico | Efectos antioxidantes | Efectos fisiológicos | Efectos beneficiosos sobre patologías crónicas |
|---|---|---|---|---|
| Inhibición actividad α-amilasa pancreática y αglucosidasa(23,24) | Reducción del nivel de colesterol LDL(31) | Modulación equilibrio oxidativo/antioxidativo (21) | Mayor excreción fecal, con mayor contenido de grasa (21) | ECV(30) |
| Inhibición parcial de los transportadores de glucosa en intestino delgado: SGLT1 y GLUT2(23,24) | Mejora del perfil lipoproteico(30) | Modulación procesos inflamatorios(21,30) | Estimulación del correcto peristaltismo (formación de gel coloidal)(31) | Comportamiento depresivo(30) |
| Reducción de la respuesta hiperglicémica postprandial y favorece mejor funcionamiento de las células βpancreáticas(21) | Propiedades hipolipemiantes: regulando metabolismo de lípidos, lipoproteínas y tejido graso(21) | Prevención de formación de nitrosaminas cancerígenas(31) | Efectividad frente a úlceras, diarrea infantil, infección intestinal y prevención de desórdenes y patologías gastrointestinales (22,30,31) | ECV e hipertensión, prevención de complicaciones micro y macrovasculares, y reducción riesgo ECV (21,30) |
| Favorece una mejor secreción de insulina, y diminución de la resistencia a la misma(21) | Inactivación radicales libres(31) | Mayor sensación de saciedad, y control peso corporal(30,31,32) | Obesidad, síndrome metabólico(30) | |
| Modulación de secuencias metabólicas del metabolismo de hidratos de carbono, retardando patologías como DMT2(30) |
Inhibición de la peroxidación lipídica inducida e inhibición de la fragmentación del ADN(30) | Captación de compuestos indeseables en el intestino, para el organismo(31) | DMT2(30) | |
| Prevención de enfermedades crónicas(30,32) | Dislipemia(30) | |||
| Aumento de las concentraciones de mucina: favorece integridad barrera intestinal(30) | Eritema por UV y cicatrización de heridas(30) | |||
| Incremento de las concentraciones de IgA secretora: impide entrada agentes patógenos (30) | Enfermedad inflamatoria intestinal y colitis ulcerosa(30) | |||
| Inflamación pulmonar (30) | ||||
| Procesos cancerosos (30) |
En paréntesis el número de las referencias bibliográficas donde se indica el efecto. DMT2, Diabetes mellitus tipo 2; ECV, enfermedad cardiovascular; GLUT2, transportador de glucosa 2; IgA, inmunoglobulina A; LDL, lipoproteínas de baja densidad; SGLT1, cotransportadores sodioglucosa-; UV: ultravioleta.
Los alimentos funcionales, son aquellos que poseen un componente, nutriente o no nutriente, con efecto selectivo sobre una o varias funciones del organismo, y con efecto añadido por encima de su valor Nutriciónal. Dichos efectos positivos justifican que pueda reivindicarse su carácter funcional o incluso saludable(27). Para poder considerar un alimento funcional, estos deben:
- Responder a las características de alimento, propiamente dicho. En ningún momento se presenta bajo forma farmacéutica. Además, han de ser ingredientes de origen natural.
- Ser consumidos dentro de una dieta alimentaria habitual.
- Ejercer función específica en el organismo que permita la mejora de algún proceso corporal concreto, o que evite el riesgo o agravamiento de enfermedades(27).
Según Celada(27) y Celada y Sánchez-Muniz(28) a la hora de elaborar un alimento funcional se puede partir de uno tradicional, al que además se le puede:
- Eliminar un componente del alimento que ejerza efecto fisiológico adverso en el organismo.
- Aumentar la concentración de un componente con efectos fisiológicos beneficiosos.
- Adicionar un componente con efectos fisiológicos positivos, que inicialmente el propio alimento no poseía.
- Aumentar la biodisponibilidad de uno o varios de sus componentes beneficiosos.
- Sustituir parcialmente un ingrediente con efectos fisiológicos negativos por otro con efectos fisiológicos positivos.
- Mezcla de alguno de los puntos mencionados anteriormente.
Para ser considerados funcionales, estos alimentos requieren pasar pruebas para comprobar que ejercen efecto saludable sobre el organismo cuando son consumidos(28). La constatación de estos efectos no sólo ha de basarse en resultados estadísticos significativos, sino que, a su vez, han de tener importancia desde el punto de vista biológico(28).
Proantocianidinas
Como se ha comentado existen muchos compuestos asociados a la fibra dietética (Tabla 1). Las proantocianidinas (PA) son compuestos polifenólicos del reino vegetal, pertenecientes al grupo de los flavonoides y a su vez a la subcategoría de los flavonoles. La principal diferencia que presentan con respecto a otros polifenoles, es que debido a su baja absorción, llegan al colon intactas, pudiendo ejercer allí sus efectos(30). Según Macho-González y col.(30) y otros autores como Alzate Tamayo y col.(31), debido a la multitud de efectos beneficiosos que presenta el consumo de PA, existe un interés creciente tanto por su estudio, como por su incorporación a la hora de diseñar alimentos funcionales. La fibra vegetal alimentaria con mayor porcentaje de compuestos polifenólicos, es la fibra de la algarroba(31). Esta se obtiene de el árbol algarrobo europeo, Ceratonia siliqua L. de la familia de las Fabaceae. Es la variedad de algarrobo más conocida en España. El elevado valor nutritivo de la pulpa del fruto del algarrobo, la vaina de algarroba, reside en los polifenoles insolubles o no extraíbles, ya que son una fuente de fibra insoluble y de antioxidantes(25). En la Figura 1, se muestra la composición media de un extracto purificado del algarrobo en el que abundan los taninos solubles y los taninos condensados tanto solubles como insolubles. Las PA se consideran taninos insolubles.
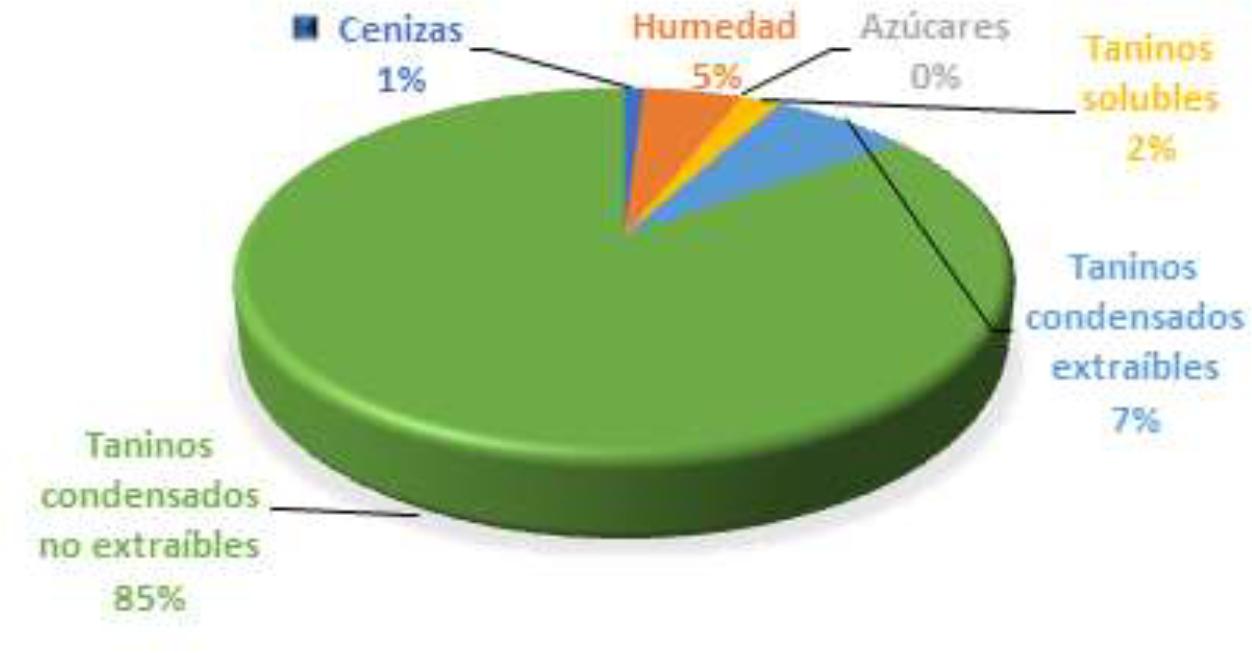
Figura 1. Composición Nutriciónal promedio de extracto de algarroba purificado. Modificado de Bastida y col.(25).
Esta fracción de polifenoles insolubles, también conocida como taninos condensados, se compone de PA poliméricas de elevado peso molecular (24). A su vez, las PA están formadas por unidades de flavan-3-ol. Estas unidades están compuestas por: a) un esqueleto de dimetilpropano (C6-C3-C6) y b) dos anillos aromáticos (A y B), que al unirse a través de tres átomos de carbono constituyen un heterociclo oxidado(30, 32) (Figura 2).
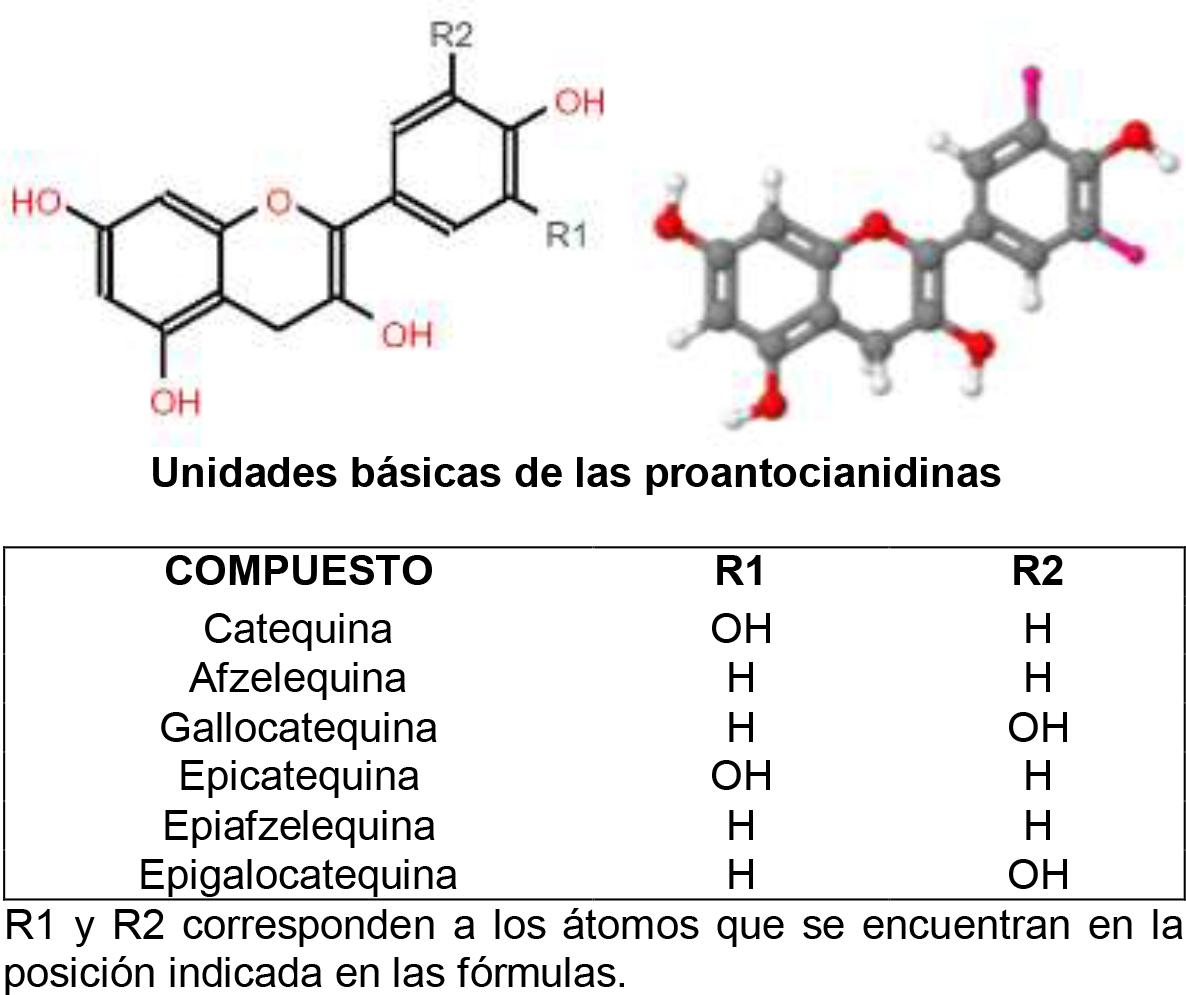
Figura 2. Estructura química básica de las proantocianidinas en 2 y 3 dimensiones, respectivamente. Modificado de Macho-González y col.(30).
Además de los efectos beneficiosos encontrados en algunos estudios mencionados en la Tabla 6 derivados del consumo de PA, hoy en día se estudia la relación que tiene su consumo con la microbiota intestinal. La teoría comúnmente aceptada a cerca del metabolismo de las PA, es que estas llegan intactas al colon, donde la microbiota intestinal las despolimeriza y fermenta, produciendo ácidos fenólicos más simples, cuya absorción y metabolismo de fase II, sí son posibles(30). Hay estudios que han demostrado que tras el consumo de PA se llega encontrar un 10% de estas en el colon a las 72 horas. Ello hace suponer que la biotransformación que sufren es elevada, aunque no completa, y que, en estos tres días, están en contacto directo con la barrera colónica, ejerciendo propiedades antioxidantes, antiinflamatorias, y anticancerígenas.
El papel que la microbiota colónica tiene con respecto a las PA es el siguiente: gracias a su actividad enzimática, las PA que no se han absorbido en el intestino delgado, son hidrolizadas, reducidas, descarboxiladas, deshidroxiladas y desmetiladas en el intestino grueso, lo que da lugar a metabolitos de menor peso molecular(30). En la Tabla 6 se presentan algunos estudios relevantes donde se ha estudiado el efecto de las PA.
Entre las bacterias presentes en la microbiota intestinal humana, destaca el papel de algunas especies en cuanto a la fermentación de las PA. Se trata de especies de Lactobacillus, Clostridium, Eubacterium, y Bacteroides. Estas especies generan en la fermentación una serie de metabolitos activos, que actúan en los diferentes tejidos del organismo. Los principales parecen ser los ácidos 3-hidroxifenilacético, 3-hidroxifenilpropiónico, 3,4-dihidroxifenilacético, benzoico y la 3-hidroxifenil-γ-valerolactona(30,32).
Respecto a los estudios realizados en animales en situaciones fisiológicas sobre el efecto de las PA en la microbiota colónica los resultados más interesantes obtenidos son los siguientes: Firmicutes es el filo bacteriano en el que se ha observado una mayor modificación en el microbioma intestinal de aquellos animales que consumieron PA(30).
Como se menciona anteriormente la presencia de bacterias de este filo en el microbioma intestinal se asocia con señal de salud, siempre que se encuentren en menor proporción que las del filo Bacteroidetes. Según Choy y col.(33) se observa un incremento del género Lactobacillus, así como también aumenta la proporción de las familias Lachnospiraceae y Ruminococcacceae, de la clase Clostridales. También Han y col.(34) sugieren en sus estudios, que el consumo de extractos ricos en PA produce modificación bacteriana en el colon, observándose de nuevo un incremento en la familia Ruminococcacceae y en el género Clostridium, aunque en este caso se observa una reducción del género Lactobacillus. La disminución de este género fue observada a su vez por Hereu y col.(35) y Lacombe y col.(36) quienes mencionan la menor abundancia de Lactobacillus plantarun tras el consumo de extracto de semilla de uva. Lacombe y col.(36) hablan de la reducción significativa en la abundancia de bacterias del género Enterococcus del filo Firmicutes. Queipo-Ortuño y col.(37), por el contrario, encuentran aumento de este último género y de Eubacterium, ambas del mismo filo.
La abundancia de las bacterias pertenecientes al filo Bacteroidetes también se ve modificada tras el consumo de extractos ricos en PA, observándose un aumento, en específico de la clase Bacteroidia (34). Otros autores como Lacombe y col.(36) y Queipo Ortuño y col.(37) demuestran un incremento significativo en la abundancia relativa de varios géneros de este filo, y detallan algunos aspectos de interés del género Prevotella. Un aumento en la abundancia de este filo se asocia a la reducción de bacterias pertenecientes al filo Firmicutes.
En cuanto al filo Actinobacteria, Lacombe y col.(36), demuestran un aumento significativo del género Bifidobacterium, el cual se encuentra normalmente en elevadas cantidades en muestras fecales de individuos sanos que consumen elevadas cantidades de fibra. Este aumento significativo también es señalado por Queipo-Ortuño y col.(37) y Espley y col.(38). No obstante, el efecto contrario fue el detectado por Pozuelo y col.(39) y Hereu y col.(35). Algunos géneros de dicho filo se relacionaron con efectos beneficiosos, mientras que otros se asociaron con efectos perjudiciales.
Por otro lado, con respecto a estudios realizados en animales en situaciones patológicas sobre el efecto de las PA en la microbiota colónica, señalar que se describe en dos artículos(40,41) el aumento significativo (30%) del género bacteriano Akkermansia, perteneciente al filo Verrucomicrobia. Este género, se considera beneficioso ya que contribuye a la prevención del aumento inducido de lipopolisacáridos inflamatorios por dietas con elevado contenido de grasa y de azúcares, así como también es capaz de revertir trastornos metabólicos inducidos por este tipo de dietas, imitando los efectos antidiabéticos de la metformina. Por tanto, se sugiere que el aumento de estas bacterias podría prevenir el fenotipo metabólico negativo que se asocia a la disbiosis provocada por la obesidad. Además, se propone que estimula la inducción de defensas antimicrobianas.
Distintos estudios(41,42) han investigado el efecto de las PA en la abundancia de bacterias del filo Firmicutes. Algunos géneros de dicho filo se han visto incrementados tras el consumo de PA, otros no. Por un lado Liu y col.(41), Masumoto y col.(43), Van Hul y col.(44) observan un aumento en el género Roseburia en la microbiota intestinal de ratones que consumieron junto a una dieta rica en grasa y azúcar un extracto de PA, en comparación con la de aquellos que no consumieron dicho extracto. Este género encontrado en pocas cantidades en la microbiota intestinal de pacientes con DMT2, juega un papel importante para la salud intestinal debido a su actividad antiinflamatoria. Otro género en el que se ha observado aumento tras el consumo de PA es Allobaculum, género que posee papel clave en la integridad intestinal, además de ser una especie productora de butirato(44). Por el contrario Masumoto y col.(41) observaron una disminución de alguna familia y género de este filo, como fueron Lachnospiraceae y Clostridium. Una reducción en este último género también fue observada por Van Hul y col.(44), quienes sugieren que se trata de un efecto positivo, ya que en aquellos ratones que consumieron una dieta rica en grasa y azúcar, este género bacteriano se vio incrementado. Liu y col.(43), en contraposición, observaron un aumento en la abundancia de bacterias del género Clostridium, así como Lee y col.(42) observan un incremento en el número de bacterias del género Lactobacillus. Varios estudios(40-42,44) señalan la disminución detectada en la relación Firmicutes/Bacteroidetes, lo que se relaciona con efectos positivos, ya que la abundancia relativa de Firmicutes aumenta en ratones genéticamente obesos y la de Bacteroidetes disminuye.
Por otro lado, algunos géneros bacterianos del filo Proteobacteria, considerados patógenos oportunistas, como los pertenecientes a la familia Desulfovibrionaceae, se han visto reducidos tras la ingesta de extractos de canela y uva ricos en PA(44). Lee y col.(42) señalan un aumento significativo en la abundancia de este filo, mayormente debido al incremento de bacterias de la clase Gammaproteobacteria, clase que ha demostrado tener propiedades antimicrobianas y antiadherentes contra bacterias patógenas.
En cuanto a las bacterias del filo Actinobacteria, se han obtenido resultados contradictorios, ya que Masumoto y col.(41) hablan de la reducción en la abundancia relativa de bacterias del género Bifidobacterium, aunque Lee y col.(42), por el contrario hayan encontrado aumento en bacterias de dicho género.
Además en la revisión sobre el papel de las PA en la microbiota, permeabilidad intestinal e inflamación(30), constata que existe una relación bidireccional entre las PA y la microbiota intestinal. Ello quiere decir que el papel de la microbiota es fundamental para transformar las PA en compuestos fenólicos biodisponibles, pero que a la vez, son las PA las que fomentan el desarrollo de bacterias beneficiosas, así como que inhiben el crecimiento de otras patógenas por su mencionado efecto prebiótico, bacteriostático e incluso bactericida.
Conclusiones y trabajos futuros
Cada vez existe más evidencia científica de los efectos beneficiosos derivados del consumo de fibra dietética.
Fibras dietéticas ricas en PA inducen abundantes efectos saludables.
Con la finalidad de que la población consuma las cantidades adecuadas para poder aprovechar dichos efectos beneficiosos, diferentes sociedades científicas han establecido unas IDR.
La ingesta actual por parte de la población es bastante inferior a las IDR establecidas.
La incorporación y consumo de PA procedentes del algarrobo en productos cárnicos ha aportado resultados muy interesantes sobre diferentes funciones de órganos, y en particular sobre la abundancia y composición de la microbiota colónica en modelos animales y en humanos(21-25).
Son necesarios más estudios y estrategias para asegurar la conveniencia del consumo de estos productos funcionales para mejorar la composición de las bacterias colónicas, y sus complejas relaciones con muchas funciones corporales.
Como el tipo de matriz alimentaria puede afectar ampliamente a los resultados(27,28), creemos que es necesario el diseño de nuevos alimentos funcionales basados en otros alimentos de habitual consumo (p.ej. cereales, cremas, pastas, golosinas, etc.)(25,45-50). Se abre por ello un campo de grandes perspectivas, donde será importante estudiar que las propiedades beneficiosas observadas para las PA en los productos cárnicos se mantienen o incluso se elevan en otros alimentos, particularmente en lo referente a la modulación de la cantidad y variedad de la microbiota intestinal y sus funciones intestinales y sistémicas derivadas. Esta estrategia permitirá por un lado asegurar el consumo de fibra y la incorporación de PA a la dieta y por otro una mayor oferta y pluralidad de tales “nuevos" alimentos.











 texto en
texto en 


