Introducción
El SARS-CoV-2 es un virus RNA perteneciente a la familia Coronaviridae. La proteína S, contiene la unión al receptor celular y ha sido utilizada para desarrollar las vacunas que protejan contra este agente1,2.
El 30 de enero de 2020 tras la reunión del Comité de Emergencias la Organización Mundial de la Salud (OMS) declaró la enfermedad COVID-19 (coronavirus disease) una emergencia de salud pública de importancia internacional exigiendo una respuesta internacional coordinada1. Para ello la vacunación frente a COVID-19 se plantea actualmente como la mejor herramienta4. En el momento actual hay evidencia de la eficacia de la vacuna frente a la infección sintomática, aunque no es el 100%. Pero el efecto de la vacunación frente a las infecciones asintomáticas y la transmisión todavía no está demostrado5.
En la Unión Europa hasta la fecha se han autorizado tres vacunas frente a COVID-19: Comirnaty Vacuna COVID-19 mRNA® (laboratorio BioNTech/Pfizer), COVID-19 Vaccine Moderna® y COVID-19 Vaccine AstraZeneca®6,7. Las primeras vacunas que se han administrado en España son las del laboratorio BioNTech/Pfizer. Hasta el 24 de enero de 2021, se habían administrado en España 1.131.805 dosis de vacunas COVID-19, habiéndose recibido 1.555 notificaciones de acontecimientos adversos7.
Desde el inicio de la epidemia hasta la fecha se han alcanzado más 106 millones de casos de COVID-19 notificados en todo el mundo, más de 34 millones en Europa y más de 3 millones en España8. Desde el inicio de la pandemia, la franja de edad más afectada ha sido la comprendida entre 50 y 59 años siendo el 55% del total de casos mujeres. Los casos hospitalizados, sin embargo, son en un 55% hombres y el 21% tienen una edad entre 70 y 79 años. La diferencia más importante entre hombres y mujeres se observa en los casos ingresados en UCI con un ratio hombre mujer de 2,2 (69% hombres)9.
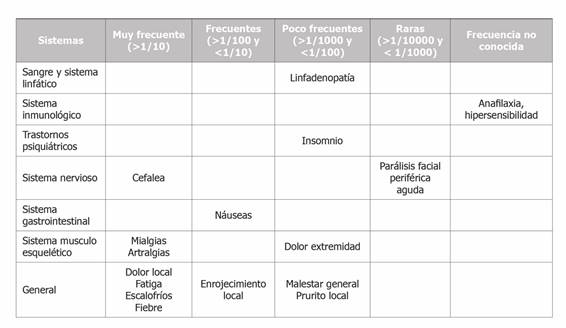
Debido a que las vacunas hacen menos probable el riesgo de infección, pero no lo impiden, y que la inmunidad se adquiere transcurridos aproximadamente 7 días desde la administración de la segunda dosis ha sido necesario diferenciar los síntomas compatibles con infección aguda con los presentados en el proceso de vacunación. Los criterios para descartar infección aguda por SARS-CoV-2 en personas vacunadas han sido establecidos recientemente por el Grupo de Trabajo de Enfermedades Infecciosas de semFYC10. (Tabla 1)
El objetivo de este estudio fue evaluar las posibles reacciones adversas a la vacuna frente al COVID-19 notificadas por los trabajadores de un hospital terciario de Madrid. Realizando una descripción de la frecuencia, la presencia en la ficha técnica, la asociación con los antecedentes de infección por SARS-COV-2 y la edad.
Justificación del estudio
El conocimiento sobre el tratamiento y prevención de la infección por SARS-Cov-2 está en continua revisión y al ser una vacunación recién aprobada en la Unión Europa es interesante hacer un análisis de las reacciones adversas reportadas para continuar aportando información a la disponible en los ensayos clínicos y en informes de farmacovigilancia.
Material y Métodos
Se realizó un análisis descriptivo retrospectivo de las posibles reacciones adversas notificadas al Servicio de Prevención de Riesgos Laborales del hospital (SPRL) tras la administración de las dos dosis de la vacuna para COVID-19 (Comirnaty®), describiendo la frecuencia de los síntomas presentados estratificando por edad, si estaban incluidas en la ficha técnica del producto, y su relación con los antecedentes de haber tenido infección previa por COVID-19.
Los periodos de vacunación analizados en el estudio fueron: desde 10 de enero hasta el 19 de enero de 2021 (primera dosis), de 1 de febrero hasta 12 de febrero de 2021 (segunda dosis).
La vacuna tras la que se ha estudiado la sintomatología presentada, ha sido la primera en ser aprobada en nuestro país, Comirnaty®, estando autorizada para producir una inmunización activa y prevenir la COVID-19 causada por el virus SARS-CoV-2, en personas de 16 años de edad y mayores. Contiene ARN mensajero (ARNm) monocatenario que codifica la proteína de la espícula (S) viral del SARS-CoV-2. La vacuna genera respuestas tanto de anticuerpos neutralizantes como de inmunidad celular contra el antígeno de la espícula (S), que pueden contribuir a la protección frente a COVID-19. La eficacia de la vacuna para todos los grupos de edad ha sido establecida en un 94,6% (IC95%: 89,9%-97,3%)11,12. Los datos de los estudios preclínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de toxicidad a dosis repetidas y de toxicidad para la reproducción y el desarrollo. En el momento actual en España se recomienda mantener la pauta que ha demostrado la eficacia descrita en la ficha técnica de la vacuna, es decir, dos dosis intramusculares (0,3 ml cada una), y la segunda tres semanas después de la primera12. Las reacciones adversas descritas en la ficha técnica de la vacuna tras los ensayos clínicos son las mostradas en la Tabla 2. Se desconoce la duración de la protección proporcionada por la vacuna, ya que todavía se está determinando en ensayos clínicos en curso12.
Tras el registro de las posibles reacciones adversas reportadas se envió la información al Centro de Farmacovigilancia de la Comunidad de Madrid y al Servicio de Prevención de la Enfermedad de la Consejería de Sanidad de la Comunidad de Madrid, siguiendo el procedimiento establecido por la Dirección General de Salud Pública4.
Población
Se realizó un estudio observacional descriptivo retrospectivo con un análisis de variables de las posibles reacciones adversas notificadas tras la vacunación frente a COVID-19 en una muestra de 8446 (6383 mujeres y 2053 hombres) trabajadores vacunados en el hospital con la primera dosis de la vacuna, y 8255 con la segunda dosis. La población está compuesta por personal sanitario y sociosanitario, en base a la estrategia de vacunación frente a COVID-19 en España, que establece que, teniendo en cuenta la disponibilidad progresiva de dosis, es necesario realizar un ejercicio de priorización teniendo en cuenta principios éticos y criterios de riesgo5. Se incluyó tanto a personal del HULP/Cantoblanco/Carlos III, como a personal del Idipaz, subcontratas y estudiantes de medicina y enfermería. Para el análisis de la relación con el antecedente de COVID-19 pasado sólo se utilizó el total de trabajadores de HULP/Cantoblanco/Carlos III vacunados (7502 dosis 1) y 7413 (dosis 2).
Variables
En el cuaderno de recogida de datos se recogieron las siguientes variables: fecha de notificación, edad, síntomas referidos, síntomas incluidos en la ficha técnica, posibles reacciones de hipersensibilidad, antecedentes de infección por COVID-19 y antecedentes personales de interés. La variable “síntomas en la ficha técnica” puede tomar valores Sí/No en función de si todos los síntomas referidos estaban ya contemplados en la ficha técnica, o si al menos uno de ellos no estaba incluido en ella. En la variable fiebre se incluyeron también los síntomas de febrícula y distermia porque en las notificaciones de los sujetos a veces no estaba especificada la temperatura termometrada ni si habían tomado antipiréticos antes.
Recogida de datos
Tras la administración de la primera dosis de la vacuna, los trabajadores llamaban al SPRL para comunicar la sintomatología que presentaban y tras la segunda dosis se implementó un sistema por el cual mediante un cuestionario notificaban por correo electrónico los síntomas presentados (Figura 1), y desde el SPRL se les contactaba en caso de ser preciso. En todos los casos se ha valorado si procedía descartar una infección aguda por SARS-CoV-2 por PCR en función del tipo de síntomas y su momento de presentación.
Análisis estadístico
La descripción de los datos cuantitativos se realizó mediante la media ± desviación típica. Los datos cualitativos se describieron a partir de las frecuencias absolutas y porcentajes. El análisis comparativo, cuando se trató de variables cualitativas, se aplicó la prueba Chi-cuadrado de Pearson. En el caso de las variables cuantitativas, las comparaciones se realizaron por pruebas no paramétricas porque se rechazó la normalidad en las distribuciones. Se utilizó el test de Mann-Whitney. P valores inferiores al umbral 0,05 se consideraron estadísticamente significativos. Todas las pruebas se consideraron bilaterales. El software estadístico empleado fue el SAS Enterprise Guide 8.2 (Cary NC, SAS Institute Inc., USA).
Este estudio fue autorizado por el Comité Ético de Investigación del HULP.
Resultados
La muestra total de trabajadores que notificaron reacciones adversas fue de 207 sujetos tras la dosis 1 (2,45% del total de vacunados) y 397 sujetos tras la dosis 2 (4,80% del total de vacunados). La media de edad fue 44,66 años (±DE 12,05) y el rango de 23 a 65 años para dosis 1. Y para la segunda dosis la media fue 42,28 años (±DE 11,59) y el rango de 20 a 64 años. Siendo mujeres un 87,44% del total de sujetos que notificaron efectos adversos tras la primera dosis, y 86,65% tras la segunda.
En la primera dosis, del total de sujetos que reportaron posibles reacciones adversas, el 76,8% eran mayores de 55 años, y en la segunda dosis fueron el 15,9%. Siendo esta diferencia porcentual estadísticamente significativa (χ2=217,38 y p<0,001).
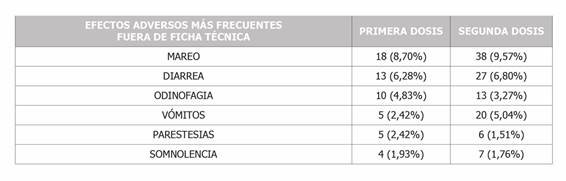
La prevalencia de reacciones adversas notificadas que ya se encontraban referenciadas en la ficha técnica del producto y según la dosis se muestra en la Tabla 3. Y en la Tabla 4 se muestran las reacciones adversas notificadas más frecuentes que no se encontraban recogidas en dicha ficha.
Las reacciones adversas analizadas que estaban descritas en la ficha técnica del producto fueron: cefalea, artralgias, mialgias, nauseas, escalofríos, dolor/enrojecimiento/prurito local en el sitio de inyección, fatiga/astenia, fiebre, dolor en el brazo de la inyección, malestar general, insomnio y linfadenopatías.
Del total de pacientes que reportaron posibles reacciones adversas tras la primera dosis, el 39,1% notificaron cefalea, y tras la segunda dosis el 51,9%. Siendo esta diferencia porcentual estadísticamente significativa (χ2=8,88 y p=0,003). La notificación de artralgias fue del 7,7% (dosis 1) y 22,4% (dosis 2), siendo estadísticamente significativo (χ2=20,44 y p<0,001). Para mialgias la notificación fue del 26,1% (dosis 1) y 57,7% (dosis 2), siendo estadísticamente significativo (χ2=54,54 y p<0,001). La notificación de escalofríos fue del 24,2% (dosis 1) y del 34,3% (dosis 2), siendo estadísticamente significativo (χ2=6,52 y p=0,011). La notificación de fatiga fue del 19,3% (dosis 1) y del 28,2% (dosis 2), siendo estadísticamente significativo (χ2=5,71 y p=0,017). La notificación de fiebre fue del 42,5% (dosis 1) y del 56,7% (dosis 2), siendo estadísticamente significativo (χ2=10,93 y p=0,001). La notificación de malestar general fue del 13% (dosis 1) y del 20,4% (dosis 2), siendo estadísticamente significativo (χ2=5,02 y p=0,025). La notificación de linfadenopatías fue del 8,2% (dosis 1) y del 15,4% (dosis 2), siendo estadísticamente significativo (χ2=6,19 y p=0,013). Las linfadenopatías reportadas más frecuentes fueron las axilares, seguidas de las cervicales y supraclaviculares del lado de la inyección.
Del total de sujetos que notificaron reacciones adversas el 57% tenía síntomas que ya estaban descritos en la ficha técnica tras la dosis 1, y el 70,5% tras dosis 2. Siendo esta diferencia porcentual estadísticamente significativa (χ2=11,07 y p=0,001).
Los resultados de los síntomas más frecuentemente notificados del grupo de reacciones que no se encontraban en la ficha técnica no han sido estadísticamente significativos (mareo, diarrea, vómitos, odinofagia, parestesias y somnolencia).
Las posibles reacciones de hipersensibilidad (alergia, anafilaxia o asma) notificadas tras la primera dosis fueron del 7,7% y tras la segunda dosis del 4,3%. No siendo esta diferencia porcentual significativa (χ2=3,13 y p=0,077). No se notificó ni se detectó en el punto de vacunación ningún caso de anafilaxia. Tampoco se notificaron casos de parálisis facial periférica aguda.
En cuanto al número de efectos adversos notificados por sujeto, la media fue de 2,15 (±DE 1,48) tras dosis 1, y de 3,27 (±DE 1,63) tras dosis 2. Y de los que figuraban en la ficha técnica la media fue 2,42 (±DE 1,52) tras dosis 1, y de 3,55 (±DE 1,74) tras dosis 2. Podemos concluir que número de efectos adversos notificados es significativamente mayor en la dosis 2 vs dosis 1 (Z=-7,6 y p- valor <0,001). Y de los de la ficha técnica también podemos concluir que el número de efectos adversos notificados es significativamente mayor en dosis 2 vs dosis 1 (Z=-8,06 y p-valor <0,001).
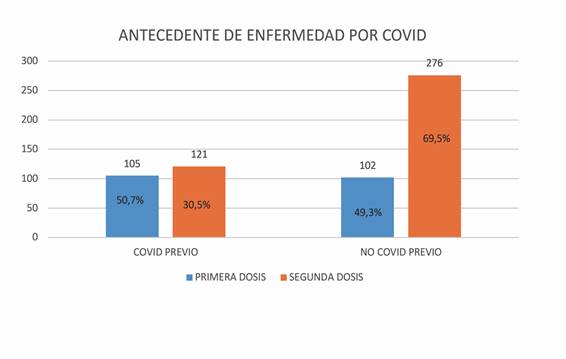
En la primera dosis, del total de pacientes que reportaron posibles reacciones adversas, el 50,7% habían sido diagnosticados COVID-19 previamente, y en la segunda dosis fueron el 30,5%. (Figura 2). Siendo esta diferencia porcentual estadísticamente significativa (χ2=23,82 y p<0,001).
Discusión
La información aportada con la notificación por parte de los trabajadores de los posibles efectos adversos sirve para detectar precozmente señales de alerta en el caso de las reacciones graves, detectar nuevas reacciones adversas, y evaluar la frecuencia real de las ya descritas. Así como detectar algún posible factor predisponente entre la población.
Es importante recordar que un acontecimiento adverso es cualquier problema de salud que ocurre después de la vacunación. No implica que necesariamente tenga que estar ocasionado por la vacuna, ya que puede tratarse de problemas médicos que coinciden en el tiempo y que también habrían ocurrido si no se hubiese vacunado o que estén relacionados con el propio acto de la vacunación (ansiedad, síncopes…)14. Los datos presentados en este estudio representan las notificaciones recibidas de acontecimientos adversos ocurridos tras la vacunación frente a la COVID-19 y no se pueden equiparar a reacciones adversas debidas a la vacuna que requieren una evaluación más detallada. Por tanto este estudio no fue diseñado para establecer causalidad.
Las reacciones adversas notificadas en nuestro estudio han sido leves o moderadas, resolviéndose en su mayoría en un plazo de 48-72h, coincidiendo con los estudios consultados(7,15,18).
La media de la muestra de edad de los sujetos que notificaron reacciones de nuestro estudio (44,66 años) es similar a la encontrada en el US Vaccine Adverse Event Reporting System (VAERS) que fue 43 años (con rango mayor al nuestro de 17 a 107 años16. En nuestro estudio la gran mayoría de personas que reportaron reacciones adversas fueron mujeres (87,44% en dosis 1 y 86,65% en dosis 2) siendo este dato ligeramente mayor al porcentaje de mujeres del total de trabajadores vacunados (75,57% para dosis 1) y a los datos de la Encuesta de Población Activa para actividades sanitarias del último trimestre de 2020 que también muestran que la población sanitaria es mayoritariamente femenina (72,56% de mujeres)17. En el estudio de Farmacovigilancia a nivel nacional también la mayoría de notificaciones correspondían a mujeres, siendo el resultado muy similar al nuestro (81%)7, al igual que en el VAERS (77%)16 y en el Canadian Adverse Events Following Immunization Surveillance System (CAEFISS)15.
La evidencia científica disponible hasta la fecha16,18,19 establece que las reacciones adversas son más frecuentes tras la segunda dosis de la vacuna Comirnaty®, coincidiendo esto con los resultados de reacciones adversas notificadas de nuestro estudio, pero consideramos que la evolución del método de notificación que ha sido diferente para la dosis 1 y para la dosis 2 ha podido influir en gran medida en el número de eventos notificados. En un estudio de la vacuna de Moderna también se encontró mayor frecuencia de reactogenicidad tras la segunda dosis20.
Es un hallazgo a destacar que en el análisis de nuestros datos se encuentra que en la primera dosis, del total de sujetos que notificaron alguna reacción adversa, el 76,8% eran mayores de 55 años, y en la segunda dosis fue el 15,9%. Siendo esta diferencia porcentual estadísticamente significativa (χ2=217,38 y p<0,001). Y que según los estudios consultados una mayor edad se asoció con una frecuencia ligeramente menor de acontecimientos de reactogenicidad12,15,19,21,22 dato compatible con los hallazgos tras la segunda dosis de nuestro estudio, pero no en la primera.
La diferencia estadísticamente significativa de sujetos cuyos síntomas estaban descritos en la ficha técnica (dosis 1: 57% y dosis 2: 70,5%) podría explicarse porque con la segunda dosis los sujetos notificaron más reacciones al estar disponible el cuestionario en intranet y se notificaron más reacciones que ya eran conocidas y en la primera dosis no llamaron para comunicarlo posiblemente al dar más importancia a las reacciones que consideraron de mayor intensidad o raras.
Con la primera dosis las reacciones más frecuentemente notificadas que ya estaban reflejadas en la ficha técnica de la vacuna fueron por orden de frecuencia: fiebre, cefalea, mialgias, escalofríos, astenia, reacción local, malestar general, náuseas, linfadenopatía, artralgias, dolor en extremidad e insomnio. Tras la segunda dosis los resultados en cuanto a orden de frecuencia fueron muy similares. (Tabla 3) La fiebre y la cefalea también figuran como las reacciones sistémicas más notificadas en otro estudio a nivel nacional7. Y en otro la frecuencia de fiebre hallada (11-16%) es menor a la de nuestro estudio (dosis 1:42,51% y dosis 2: 56,68%) ya que sólo contabilizaron la fiebre de más de 38ºC y representa la frecuencia del total de sujetos, y no sólo de los casos notificados como en nuestro caso11.
Tabla 3. Prevalencia de reacciones adversas notificadas que ya se encontraban referenciadas en la ficha técnica del producto.
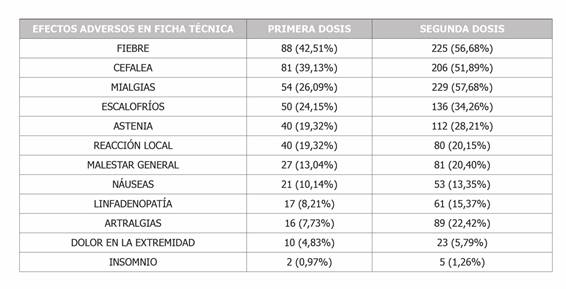
La reacción local más frecuentemente reportada entre los sujetos de los estudios consultados fue dolor en el sitio de la inyección7,11,15,18, pero en nuestro estudio no figura en primer lugar ya que no se notificaron absolutamente todas las reacciones producidas independientemente de su intensidad si no sólo las que los trabajadores consideraron reportar en función de la preocupación que les generaba o de si le incapacitaban para acudir al trabajo.
La anafilaxia es una reacción adversa descrita en la ficha técnica de la vacuna. En los estudios consultados se encontró una tasa de notificación de 7,2 casos de anafilaxia por millón de dosis administradas en España7 y 5 casos por millón en Estados Unidos16, siendo mayor a lo hallado en nuestro estudio que fue cero ya que la muestra era mucho menor. En nuestro estudio no se notificó ninguna parálisis facial periférica aguda ni en los datos de la Agencia Reguladora de Medicamentos y Productos Sanitarios de Reino Unido21, pero sí hubo pocos casos en los ensayos clínicos que figuran en la ficha técnica12.
Las reacciones más frecuentemente notificadas tras la primera dosis que no estaban contempladas en la ficha técnica fueron por orden de frecuencia: mareo, diarrea, odinofagia, vómitos, parestesias y somnolencia. Tras la segunda dosis los resultados en cuanto a orden de frecuencia fueron muy similares (Tabla 4). Los mareos, diarrea y vómitos fueron también reportados excepcionalmente en otros estudios7,11,16,18,21. Y las parestesias en el estudio canadiense15.
Tabla 4. Prevalencia de reacciones adversas notificadas que no se encontraban referenciadas en la ficha técnica del producto.
Respecto al número de efectos adversos notificados por cada sujeto hay que tener en cuenta que el número está afectado por la importancia que los trabajadores le dieron a la hora de notificar unos efectos frente a otros (por ejemplo que notificasen una linfadenopatía porque la que estuviesen preocupados pero no le diesen importancia a si tenían también dolor local o malestar general). Por tanto, los efectos notificados son un número mínimo, al no haberse realizado mediante un cuestionario en el que los sujetos verificasen que no padecían los demás efectos adversos consultados marcando la opción de “no presenta”. Pero asumimos que ese factor influye de manera similar al registro de ambas dosis o que incluso pudo interferir más en el registro de dosis 2 (donde ya se usaba el cuestionario como método principal de notificación) y el número de efectos adversos es significativamente mayor en la dosis 2 vs dosis por lo que podría estar también en relación al punto anteriormente comentado en que las reacciones adversas en nuestro estudio son más frecuentes tras la segunda dosis de la vacuna y en los estudios consultados16,6,7.
En la primera dosis, del total de pacientes que reportaron posibles reacciones adversas, el 50,7% habían sido diagnosticados COVID-19 previamente, y en la segunda dosis fueron el 30,5%. Siendo esta diferencia porcentual estadísticamente significativa (χ2=23,82 y p<0,001). Para el análisis de la relación de las reacciones adversas notificadas con el antecedente de COVID-19 previo se utilizaron los datos de nuestro centro de trabajo, el HULP/Carlos III/Cantoblanco con 8329 trabajadores, de los cuales el 24,91% habían tenido COVID-19 a fecha 12 de febrero de 2021. Y teniendo en cuenta que con la primera dosis de los 207 sujetos que reportaron, 105 tenían antecedente de COVID-19 y 102 no, se calculó el porcentaje de trabajadores con COVID previo que reportaron en relación al total de trabajadores vacunados con la primera dosis con COVID previo (1869), siendo 5,62%. Y el porcentaje de trabajadores sin COVID previo que notificaron respecto al total de trabajadores vacunados con la primera dosis sin COVID previo (5633) fue 1,81%. Se realizó el mismo cálculo para la dosis 2, donde de los 307 sujetos que reportaron 121 tenían antecedente de COVID-19 y 276 no, se calculó el porcentaje de trabajadores con COVID previo que reportaron en relación al total de trabajadores vacunados con la segunda dosis con COVID previo (1847), siendo 6,55%. Y el porcentaje de trabajadores sin COVID previo que notificaron respecto al total de trabajadores vacunados con la segunda dosis sin COVID previo (5566) fue 4,96%. Pudiendo concluir que hubo más trabajadores con antecedente por COVID previo que reportaron versus trabajadores sin COVID previo que reportaron reacciones, sobre todo tras la primera dosis. En los estudios consultados se observó que el perfil de seguridad de los sujetos que eran seropositivos para el SARS-CoV-2 en el momento de la vacunación fue similar al observado en la población general12.
Se han encontrado pocos estudios con los que poder comparar nuestros resultados, debido posiblemente a que la vacuna está disponible desde hace poco tiempo (en España en enero de 2021).
Como principales limitaciones y posibles sesgos de nuestro estudio podemos mencionar que el sistema de notificación de reacciones adversas que ha sido diferente para la dosis 1 que para la dosis ha dificultado el análisis y la comparación de los datos. Asimismo para sacar conclusiones sobre la frecuencia de efectos no deseados tras la vacunación deberían reportarse todos los eventos ocurridos y no solamente las reacciones que el trabajador haya considerado de más interés o intensidad. Por tanto los resultados son difícilmente comparables en algunos aspectos con los obtenidos en los ensayos clínicos de las vacunas donde se reportan y se cuantifican todos los efectos producidos tras la vacunación.
Hay que aclarar que los profesionales sanitarios y la población deben seguir manteniendo las medidas de protección recomendadas frente al COVID-19, con independencia de si están o no vacunados, ya que en el momento actual aún se desconocen ciertos aspectos sobre la protección conferida por la vacuna y su duración24,25. Posiblemente en un futuro cuando se esclarezcan algunos aspectos científicos se podrán dar recomendaciones específicas para personas que han recibido la vacunación.
Y, en conclusión, en nuestro estudio se confirma que las reacciones adversas notificadas tras la vacunación han sido leves o moderadas. No obstante, deberá continuarse estudiando las reacciones producidas tras la vacunación y su relación de causalidad con ella.