Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales de Medicina Interna
versión impresa ISSN 0212-7199
An. Med. Interna (Madrid) vol.23 no.10 oct. 2006
Infección por el virus de Epstein-Barr y hepatitis aguda colestásica
Epstein-Barr virus infection and cholestatic hepatitis
M. Barreales, M. Pérez-Carreras, T. Meizoso1, M. Garrido1, A. Masedo, F. Colina1, J. A. Solís
Servicios de Medicina, Aparato Digestivo y 1Anatomía Patológica. Hospital Universitario 12 de Octubre. Madrid
RESUMEN
El virus de Epstein-Barr (VEB) es un herpesvirus cuyo único huésped es el hombre, al que infecta por vía orofaríngea. La primoinfección generalmente es asintomática o cursa como una mononucleosis infecciosa que se caracteriza por fiebre, adenopatías, esplenomegalia y amigdalitis. El diagnóstico de la infección aguda suele ser serológico (anticuerpos heterófilos o específicos para el VEB), aunque el virus también puede detectarse en los tejidos mediante inmunohistoquímica o por técnicas de biología molecular. Habitualmente la infección por el VEB produce una alteración leve y autolimitada de las transaminasas (AST y ALT), por lo que no suele precisarse una biopsia hepática, y solo en el 5% causa una hepatitis aguda colestásica (HAC).
Presentamos a un paciente con una HAC e infección aguda por el VEB, con linfocitos atípicos en sangre periférica y anticuerpos IgM contra la cápside VCA, que había tomado tóxicos (ibuprofeno, paracetamol y valeriana). La evolución tórpida del cuadro, la relación cronológica con la exposición a fármacos y los escasos casos publicados de HAC atribuidos al VEB, recomendaron realizar una biopsia hepática. Aunque el estudio de biología molecular en el tejido hepático resultó positivo para el VEB, los hallazgos morfológicos no permitieron excluir el origen tóxico ni la posible interacción entre fármacos y el propio virus en la etiología del cuadro.
Palabra clave: Virus de Epstein-Barr. Mononucleosis infecciosa. Hepatitis viral. Hepatitis tóxica. Colestasis.
ABSTRACT
Epstein-Barr virus (EBV) is a herpesvirus whose only reservoir host is the human. It is transmitted by oropharyngeal secretions. Primary EBV infection is usually asymptomatic, but sometimes it causes infectious mononucleosis with fever, lymphadenopathies, splenomegaly and pharyngitis. Acute infection is diagnosed by serology (heterophile or specific antibodies). Immunofluorescence and molecular biologic techniques may be used to demonstrate the presence of EBV in biopsy specimens. Mild and transient elevations of serum aminotransferases are common, thus liver biopsy is usually not necessary to confirm the diagnosis. Severe cholestasis is rare (5%).
We describe a patient with cholestatic hepatitis and acute EBV infection with atypical lymphocytes and positive anti-VCA IgM. The patient had taken drugs (ibuprofen, paracetamol and valerian). The bad evolution of the patient, the history of exposure to drugs, and the few cases of cholestatic hepatitis due to EBV infection reported, led us to consider liver biopsy. Molecular biologic techniques confirmed the presence of EBV in liver tissue however histologic features did not exclude the toxic aetiology or the concomitant effect of drugs and EBV infection.
Key words: Epstein-Barr virus. Infectious mononucleosis. Viral hepatitis. Toxic hepatitis. Cholestasis.
Introducción
El virus de Epstein-Barr (VEB) es un virus DNA, cuyo único huésped conocido es el hombre. Es un miembro de la familia de los herpesviridae, que se caracterizan por su capacidad para persistir en estado latente e inducir inclusiones intranucleares en las células que infectan. La infección por el VEB se adquiere por vía orofaríngea, generalmente por el beso, desde donde se disemina a través del sistema linforreticular, estimulando la inmunidad celular y humoral. La primoinfección por el VEB puede manifestarse de forma asintomática, sobre todo en niños, o como una "mononucleosis infecciosa" (MNI), en adultos jóvenes. También se ha relacionado a este virus con tumores como el linfoma de Burkitt, algunos linfomas no Hodgkin y el carcinoma nasofaríngeo (1). El 80% de los individuos adultos sanos tiene evidencia serológica de infección por el VEB, pero el diagnóstico de infección aguda requiere la determinación de anticuerpos heterófilos y/o la detección de anticuerpos específicos contra el virus. Existen también técnicas de inmunofluorescencia para detectar algunas proteínas del virus en los tejidos y de biología molecular, que detectan secuencias del RNA o DNA del VEB (1,2).
La MNI es la manifestación clínica más frecuente de la infección aguda por el VEB y se caracteriza por fiebre, hepatoesplenomegalia, amigdalitis, adenopatías y molestias abdominales. En la mayoría de los casos la MNI cursa con una elevación leve y autolimitada de las transaminasas, por lo que la afectación hepática no suele documentarse histológicamente, y sólo en el 5% de los casos se ha asociado con hepatitis aguda colestásica (HAC) (3-6).
Presentamos el caso de un paciente diagnosticado de HAC y primoinfección por el VEB, en el que la toma simultánea de fármacos potencialmente hepatotóxicos, obligó a realizar una biopsia hepática.
Caso aportado
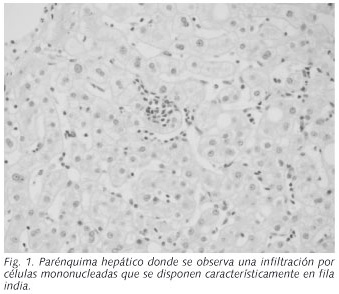
Varón de 40 años de edad, sin hábitos tóxicos, con antecedentes de dislipemia y esteatosis hepática ecográfica, que ingresa en nuestro hospital por un cuadro de ictericia y alteración de la bioquímica hepática de dos días de evolución. Quince días antes había presentado un cuadro seudogripal en forma de fiebre, artralgias, tos seca y cefalea, para el que recibió tratamiento con paracetamol, ibuprofeno y un producto de herbolario que contenía valeriana. En la exploración física destacaba la obesidad y la presencia de ictericia mucocutánea, sin estigmas de hepatopatía crónica. Se palpaba una hepatomegalia lisa a 2 cm del reborde costal derecho, sin esplenomegalia ni adenopatías. Los estudios de laboratorio mostraron los siguientes resultados: Hb: 15,5 g/dl; plaquetas: 324.000/mm3; leucocitos: 11.400/mm3, con linfocitosis (74%) y linfocitos atípicos activados en la extensión de sangre periférica; bilirrubina total (BR): 8.2 mg/dl; AST: 182 U/L; ALT: 428 U/L; fosfatasa alcalina (FA): 541 U/L; ALT/FA< 2, GGT: 1.690 U/L; LDH: 339 U/L; albúmina: 3,9 g/dl; colesterol: 371 mg/l; triglicéridos: 421 mg/l; estudio de coagulación y función renal normales. El estudio de autoinmunidad y metabólico de causas de enfermedad hepática, fue negativo. También lo fueron las serologías del virus de la hepatitis A, B y C, incluyendo el RNA del VHC. La serología de infección antigua por citomegalovirus (IgG) y los anticuerpos-IgM contra la cápside del VEB (VCA), resultaron positivos, coincidiendo con anticuerpos-IgG nucleares negativos para este mismo virus. La ecografía abdominal demostró signos de hígado graso, sin dilatación de la vía biliar ni litiasis. La evolución analítica fue favorable, pero un mes después del ingreso aún persistían datos bioquímicos de colestasis, motivo por el que se realizó una biopsia hepática percutánea. La histología mostraba un tejido hepático con arquitectura conservada, aunque con leve ampliación fibrosa portal, e inflamación en tractos portales en forma de infiltrado mixto constituido por linfocitos, eosinófilos, células plasmáticas y células linfoides de mayor tamaño (linfocitos activados). Este infiltrado sobrepasaba la trabécula limitante periportal. El lobulillo también presentaba una infiltración inflamatoria de linfocitos de tamaño habitual y activados que se disponían en "fila india" (Fig. 1). Existían cambios degenerativos de células hepáticas, como cuerpos acidófilos y cambios hidrópicos, así como hiperplasia de macrófagos Küpfferianos. Menos de un 10% de los hepatocitos mostraban macrovacuolas esteatósicas. El cuadro histológico se correspondía con un "patrón de hepatitis lobulillar y periportal compatible con hepatitis aguda, sin signos morfológicos definitivos de etiología". Se realizó hibridación in situ para EBER ("Epstein-Barr virus encoded RNA") que resultó positiva en los linfocitos activados (Fig. 2).
Discusión
La MNI suele cursar con una alteración leve de las transaminasas, que en la mayoría de los casos se normaliza de forma espontánea en 2 ó 3 semanas (1-3). Dicha alteración generalmente consiste en una elevación ligera de las enzimas de citolisis (ALT y AST), aunque se han publicado algunos casos de hepatitis colestásica (bilirrubina x 2N, GGT x 3N, FA x 2N y cociente ALT/FA < 2, siendo N el valor de referencia considerado como normal) (4-6). No se conoce el mecanismo exacto por el que el VEB produce daño hepático, aunque se ha descartado un efecto citopático directo y se ha especulado que las células inflamatorias reactivas a la proliferación de linfocitos B inducida por el VEB (linfocitos T y células natural-killer), podrían estar implicadas en la necrosis hepatocelular (1,3,7). Tampoco se ha establecido el mecanismo por el cual el VEB es capaz de provocar colestasis, pero podría justificarse por la inhibición de la enzima antioxidante superóxido dismutasa o por la infección directa del epitelio biliar por el VEB (4,6).
Existen pocos casos publicados de hepatitis aguda por el VEB demostrada histológicamente. La afectación hepática ocasionada por dicho virus se caracteriza por un aumento del número de linfocitos en los sinusoides, que se disponen de forma típica en "fila india" (4) y que pueden ser algo atípicos, con un citoplasma abundante y un diámetro nuclear mayor de lo habitual (8). Otros cambios morfológicos asociados al VEB son: un infiltrado linfocitario denso en los espacios porta, focos de necrosis hepatocelular moderada, proliferación de células de Küpffer y, ocasionalmente, granulomas. No se han hallado inclusiones de tipo viral características de este virus (9,10).
El diagnóstico de MNI suele establecerse por el cuadro clínico típico asociado al estudio serológico positivo, el cual consiste en determinar los anticuerpos inespecíficos o heterófilos (prueba de Paul-Bunnell), y los específicos contra la cápside (VCA), contra los antígenos precoces (EA) y contra los antígenos nucleares (EBNA) del VEB (1,2). El paciente que comunicamos presentaba un síndrome típico de HAC asociado a un cuadro clínico, analítico y morfológico compatible con una infección activa reciente por el VEB. Así, el antecedente de un cuadro seudogripal, junto con la presencia linfocitos atípicos activados en sangre periférica (2,4) y la positividad de anticuerpos VCA-IgM, apuntaba al VEB como la causa más probable de la HAC que había motivado el ingreso. No obstante, el predominio de la colestasis y la escasa mejoría analítica tras más de 4 semanas de seguimiento, así como la relación cronológica con la toma de ibuprofeno y un compuesto de herbolario, nos indujeron a considerar la etiología tóxica del cuadro y a plantear la realización de una biopsia hepática.
La toxicidad por fármacos es responsable del 10% de las hepatitis agudas y de más de la mitad de los casos de insuficiencia aguda grave. La forma de presentación habitual es un cuadro que simula el de la hepatitis viral aguda ictérica, aunque puede remedar cualquier síndrome hepático agudo, hepatítico, colestásico o mixto. No existen rasgos clínicos, bioquímicos ni histológicos específicos de hepatotoxicidad medicamentosa, lo que impide su identificación como agente etiológico seguro (11). El grupo de los antiinflamatorios no esteroideos (AINE) es uno de los implicados con mayor frecuencia, aunque la lesión aguda hepática es un acontecimiento raro en la población general, si se usan a las dosis recomendadas. Se considera que el daño celular por AINE es idiosincrásico, producido generalmente por un mecanismo de hipersensibilidad inmunitaria, independiente de la dosis, y que el riesgo es mayor cuando se asocia a la toma de otros fármacos (12). El paciente que presentamos había tomado un AINE, ibuprofeno, al que se han llegado a atribuir casos de fallo hepático a dosis terapéuticas (13), junto con paracetamol y un compuesto de herbolario. Desde el punto de vista morfológico, el mecanismo causal de la hepatitis lobulillar con colestasis, que encontramos en la biopsia de nuestro caso, incluye a todas las hepatitis provocadas por virus y a aquellas reacciones adversas a fármacos de mecanismo alérgico. El paracetamol puede excluirse como agente etiológico en nuestro enfermo, ya que suele provocar citolisis y lesión en forma de necrosis central cuando su dosis es excesiva, como en casos de tentativa de suicidio. Sin embargo, el ibuprofeno sí puede producir necroinflamación y colestasis por hipersensibilidad, justificando una lesión histológica como la que encontramos en nuestro paciente.
La popularización del uso de compuestos herbales ha convertido su toxicidad en un problema emergente en nuestro medio, del que se desconocen muchos aspectos (14-16). Están descritos cambios histológicos provocados por remedios herbales como esteatosis, hepatitis lobulillar aguda y crónica, fibrosis hepatocitaria, necrosis zonal o difusa, daño biliar y enfermedad venoclusiva (14,15). Se conoce el efecto tóxico de la valeriana in vitro (17), pero existe poca información en la literatura sobre su capacidad para provocar toxicidad hepática en estudios clínicos y tampoco se han descrito cambios morfológicos atribuibles a este compuesto (18), hechos que hacen menos probable su participación en el cuadro que comunicamos.
El diagnóstico de hepatitis tóxica está basado en escalas de puntuación y la biopsia hepática solo está justificada si existen dudas etiológicas, como era este caso. En el enfermo que presentamos, la relación temporal era compatible con hepatotoxicidad, pero el único método para confirmarlo requiere observar un nuevo deterioro del perfil hepático tras la readministración del fármaco, y esta maniobra solo se considera ética si éste es imprescindible para el individuo (11). Histológicamente, nuestro paciente tenía varios datos a favor de la existencia de hepatotoxicidad como el infiltrado inflamatorio con eosinófilos, la lesión combinada hepatocelular y colestásica y la presencia de esteatosis (si bien este último hallazgo podría ser una característica basal del paciente, que ya estaba diagnosticado de un hígado graso ecográfico), hallazgos morfológicos que, sin un estudio inmunohistoquímico específico para el VEB, no permiten afirmar ni descartar la etiología viral sola o en combinación con hepatotoxicidad. Diversos estudios han relacionado algunas infecciones virales con la toma de fármacos y preparados herbales. Así, algunos virus inducen reacciones adversas por fármacos, como ocurre en el síndrome de Reye (aspirina) o en la MNI (ampicilina). Este mecanismo se ha implicado también en algunos casos de hepatotoxicidad por paracetamol (19,20) o en brotes de hepatitis inducida por ibuprofeno en pacientes con infección crónica por el VHC (13,21). También se han relacionado ciertos extractos vegetales con el carcinoma nasofaríngeo inducido por el VEB, especulando sobre la capacidad de estos compuestos para reactivar una infección latente y su posible efecto proliferativo directo sobre las células transformadas por el virus (22, 23). Además, existe constancia de las interacciones presentes entre fármacos y productos herbales, como el aumento de la toxicidad hepática por paracetamol cuando se usa conjuntamente con hierbas hepatotóxicas (24). En nuestro caso, el diagnóstico definitivo se estableció mediante la demostración histológica del RNA del virus empleando técnicas de biología molecular, dichas técnicas son negativas en los portadores asintomáticos (25).
En la observación clínica que comunicamos de HAC asociada a una primoinfección por el VEB, la presentación y el curso clínico atípicos podrían explicarse por una interacción entre fármacos, productos herbales y el propio virus, dando lugar a un cuadro mixto de daño hepático, de etiología farmacológica y vírica. Ambos factores deben incluirse siempre en el diagnóstico diferencial de toda HAC.
Bibliografía [ Links ]
2. Markin RS. Manifestations of Epstein-Barr virus-associated disorders in liver. Liver 1994; 14: 1-13. [ Links ]
3. Kimura H, Nagasaka T, Hoshino Y, Hayashi N, Tanaka N, Xu JL, et al. Severe hepatitis caused by Epstein.Barr virus without infection of hepatocytes. Hum Pathol 2001; 32: 757-762. [ Links ]
4. Hinedi TB, Koff RS. Cholestatic hepatitis induced by Epstein-Barr virus infection in an adult. Dig Dis Sci 2003; 48: 539-541. [ Links ]
5. Edoute Y, Baruch Y, Lachter J, Furman E, Bassan L, Assy N. Severe cholestatis jaundice induced by Epstein-Barr virus infection in the elderly. J Gastroenterol Hepatol 1998; 13. 821-824. [ Links ]
6. Bernstein CN, Minuk GY. Infectious mononucleosis presenting with cholestatic liver disease. Ann Intern Med 1998; 128: 509. [ Links ]
7. Papatheodoridis GV, Delladetsima JK, Kavallierierou L, Kapranos N, Tassopoulos NC. Fulminant hepatitis due to Epstein-Barr virus infection. J Hepatol 1995; 23: 348-350. [ Links ]
8. Purtillo DT, Sakamoto K. Epstein-Barr virus and human disease: immune response determines the clinical and pathologic expresion. Hum Pathol 1981; 12:677-679. [ Links ]
9. Nenert M., Mavier P., Dubuc N, Deforges L, Zafrani ES. Epstein-Barr virus infection and hepatic fibrining granulomas. Hum Pathol 1988; 19:608-610. [ Links ]
10. Sevilla J, Escudero MC, Jiménez R, González-Vicent M, Manzanares J, García-Novo D, et al. Severe systemic autoimmune disease associated with Epstein-Barr virus infection. J Pediatr Hematol Oncol 2004; 26:831-833. [ Links ]
11. Andrade RJ, Lucena MI. Toxicidad por medicamentos: detección y tratamiento. Gastroenterol Hepatol 2005; 28: 1-11. [ Links ]
12. O'Connor N, Dargan PI, Jones AL. Hepatocellular damage from non-steroidal anti-inflammatory drugs. QJM 2003; 96: 787-791. [ Links ]
13. Rodríguez-González FJ, Montero JL, Puente J, Fraga E, Costan G, Barrera P et al. Orthotopic liver transplantation after subacute liver failure induced by therapeutic doses of ibuprofen. Am J Gastroenterol 2002; 97: 2476-2477. [ Links ]
14. Chitturi S, Farrell GC. Herbal hepatotoxicity: an expanding but poorly defined problem. J Gastroenterol Hepatol 2000; 15: 1093-1099. [ Links ]
15. Park E, Esrason KT, Wu VH. Hepatotoxicity of herbal remedies: an emerging dilema. Prog Transplant 2004; 14: 91-96. [ Links ]
16. Stedman C. Herbal hepatotoxicity. Semin Liver Dis 2002; 22: 195-206. [ Links ]
17. Vo LT, Chan D, King RG. Investigation of the effects of peppermint oil and valerian on rat liver and cultured human liver cells. Clin Exp Pharmacol Physiol 2003; 30: 799-804. [ Links ]
18. Chan TY, Tang CH, Critchley JA. Poisoning due to an over-the-counter hypnotic, Sleep-Qik (hyoscine, cyproheptadine, valerian). Postgrad Med J 1995; 71: 227-228. [ Links ]
19. Levy M. Role of viral infections in the induction of adverse drug reactions. Drug Saf 1997; 16: 1-8. [ Links ]
20. Descamps V, Mahe E, Houhou N, Abramowitz L, Rozenberg F, Ranger-Rogez S, et al. Drug-induced hypersensitivity syndrome associated with Epstein-Barr virus infection. Br J Dermatol 2003; 148: 1032-1034. [ Links ]
21. Riley TR, Smith JP. Ibuprofen-induced hepatotoxicity in patients with chronic hepatitis C: a case series. Am J Gastroenterol 1998; 93: 1563-1565. [ Links ]
22. Mizuno F, Koizumi S, Osato T, Kokwaro JO, Ito Y. Chinese and african euphorbiaceae plant extracts: markedly enhancing effect on Epstein-Barr virus-induced transformation. Cancer Lett 1983; 19: 199-205. [ Links ]
23. Hildesheim A, West S, De Veyra E, De Guzmán MF, Jurado A, Jones C et al. Herbal medicine use, Epstein-Barr virus, and risk of nasopharyngeal carcinoma. Cancer Res 1992; 52: 3048-3051. [ Links ]
24. Abebe W. Herbal medication: potencial for adverse interactions with analgesic drugs. J Clin Pharm Ther 2002; 27: 391-401. [ Links ]
25. Yuge A, Kinoshita E, Moriuchi M, Ohno Y, Haga H, Moriuchi H. Persistent hepatitis associated with chronic active Epstein-Barr virus infection. Pediatr Infect Dis J 2004; 23:74-76. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Mónica Barreales Valbuena
Hospital Universitario 12 de Octubre
Avda de Córdoba s/n
28041 Madrid (España)
Trabajo Aceptado: 5 de abril de 2006