Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.24 no.3 Madrid may./jun. 2009
Interacción de los antineoplásicos orales con los alimentos: revisión sistemática
Antineoplastic oral agents and drug-nutrient interactions: a sistematic review
N. V. Jiménez Torres1,2, I. Romero Crespo1, M. Ballester Solaz3, A. Albert Marí1 y V. Jiménez Arenas4
Servicio de Farmacia. Hospital Universitario Dr. Peset. Valencia.
1Facultativo Especialista en Farmacia Hospitalaria.
2Departamento de Farmacia y Tecnología Farmacéutica. Facultad de Farmacia. Universidad de Valencia.
3Licenciada en Farmacia.
4Unidad de Investigación Epidemiológica (EPIFARM). CSISP. Conselleria de Sanitat. Valencia. España.
Dirección para correspondencia
RESUMEN
Introducción: Los estudios de biodisponibilidad son parte integrante del desarrollo clínico de medicamentos para administración oral con el fin de identificar potenciales interacciones fármaco-alimento (iFA). Actualmente, para los antineoplásicos orales se empieza a reconocer su importancia clínica, aun cuando lamentablemente, la información disponible presenta variabilidad en su evidencia científica.
Objetivos: Revisar la evidencia científica disponible sobre las interacciones de los alimentos con medicamentos antineoplásicos orales y establecer recomendaciones para su administración.
Métodos: Se realizó una búsqueda bibliográfica en Medline y The Cochrane Library para el periodo comprendido entre enero de 1966 a marzo de 2008, enfocada a identificar las publicaciones sobre interacciones fármaco alimento con antineoplásicos orales. El análisis bibliográfico consta de dos fases. En la primera fase se excluyeron los artículos que por título y contenido del resumen no se correspondían con el objetivo planteado; en la segunda fase se eliminaron las referencias duplicadas en ambas bases de datos.
Los criterios de inclusión para seleccionar los artículos fueron: diseño (revisiones sistemáticas, metaanálisis, ensayos clínicos randomizados Fase I y II), población (pacientes adultos; >19 años de edad), intervención evaluada (administración de antineoplásicos orales bajo condiciones de ayuno o con alimentos) y medida del resultado de la iFA (cálculo del IC90% de la razón entre la media geométrica de valores del área bajo la curva de concentraciones plasmáticas (ABC) o la concentración plasmática máxima (Cmax) con y sin alimentos). Se excluyeron las publicaciones que como medida de resultado no hacían referencia al dictamen de bioequivalencia establecido por la Food and Drugs Administration (FDA). La valoración crítica de los artículos seleccionados se realizó según las recomendaciones que de acuerdo con la FDA deben cumplir estos estudios.
Resultados: En la búsqueda inicial se obtuvieron 850 referencias (98,5% Medline + y 1,4% Cochrane). En la primera fase se excluyeron el 87,7% (746) de los artículos, correspondiendo el 100% a la búsqueda en Medline. En la segunda fase, quedaron 40 artículos (5,2% de los iniciales) para su lectura crítica a texto completo, a los que se añadieron cuatro más no indexados en Medline.
De la lectura crítica de los 44 artículos finales, se excluyeron 25 artículos (20 artículos originales, 4 comunicaciones cortas y 1 metanálisis) por no incluir como medida de resultado el dictamen de bioequivalencia. Los 19 (2,2%) artículos restantes proporcionaron información sobre 19 fármacos antineoplásicos orales, en 210 pacientes y 146 voluntarios sanos. De estos 19 fármacos, el 63% no presentan iFA o interacciones fármaco-alimento, pudiéndose administrar indistintamente con/sin alimentos; el 21% se deben administrar con alimentos y sólo el 16% presentan interacción fármaco alimento, por lo que se deben administrar sin alimentos.
Discusión: Actualmente, la importancia clínica de las interacciones fármaco alimento con antineoplásicos orales se identifica más directamente con la seguridad del paciente que con la efectividad del tratamiento.
Ante el desarrollo de estos agentes orales, su irrupción en la terapia oncológica desplazando a la terapia parenteral, con costes mensuales de miles de euros, hay necesidad de realizar estudios farmacocinéticos y farmacodinámicos bien diseñados. Su objetivo debe de ser comparar su biodisponibilidad en presencia o ausencia de alimentos con la respuesta clínica. Mientras tanto, establecer recomendaciones para su administración en relación con los alimentos, es inconsistente para algunos de estos fármacos y su resultado incierto por la falta de estudios fundamentados en el dictamen de bioequivalencia establecido por la FDA.
Palabras clave: Agentes antineoplásicos. Efecto de los alimentos. Quimioterapia oral. Farmacocinética. Revisión sistemática.
ABSTRACT
Introduction: studies on bioavailability are part of the clinical development of drugs for oral use in order to identify potential drug-food interactions. For oral antitumor drugs, their clinical importance is currently recognized although regrettably the information available presents variability concerning the scientific evidence.
Objectives: To review the available scientific evidence about oral anti-tumor medications and establish the recommendations for their administration with foods.
Methods: We carried out a bibliographic search in Medline and The Cochrane Library for the period January of 1966 to March of 2008, focused on identifying those publications about drug-food interactions with oral antitumor medications. The bibliographical analysis was made in two steps. During the first phase, we excluded those articles in which the title or their content did not correspond with the objective settled; during the second phase, we deleted all the references duplicated in both databases.
The inclusion criteria to select the articles were: design (systematic reviews, meta-analysis, Phase I and Phase II randomized clinical trials), population (adult patients; >19 years of age), intervention evaluated (administration of oral anti-tumor drugs under fasting conditions or with food) and measurement of the iFA results (calculation of the 90% CI of the odds ratio between the geometric mean of the values under the curve of the plasma concentrations (ABC) or the maximal plasma concentration (Cmax) with and without foods). We excluded those publications that did not make reference to the bioequivalence dictamen established by the Food and Drugs Administration (FDA) in their outcomes measurement. A critical appraisal of the selected articles was done according to the recommendations that the FDA established to be met by these studies.
Results: At the initial search we obtained 850 references (98.5% Medline + and 1.4% Cochrane). During the first phase, we excluded 87.7% (746) of the articles, 100% of them corresponding to the search in Medline. During the second phase, 40 studies remained (5.2% of the initial ones) for full-text critical appraisal, to which four studies were added not indexed in Medline.
From the critical appraisal of the 44 final articles, 25 were excluded (20 original articles, 4 short communications, and 1 meta-analysis) because they did not include as an outcome measure the bioequivalence dictamen. The 19 (2.2%) remaining articles provided information on 19 oral anti-tumor drugs in 210 patients and 146 healthy volunteers. Of these 19 drugs, 63% did not present drugfood interactions, with the possibility of administering them either with or without food; 21% have to be administered with foods and only 16% present drug-food interactions, so they have to be administered without foods.
Discussion: Currently, the clinical importance of drugfood interactions with oral anti-tumor drugs is identified more directly with the patient's safety than with the efficacy of the therapy. Given the development of these oral agents, their incorporation into the oncologic strategy displacing parenteral therapy, with monthly costs of thousands of Euros, it is necessary to perform well-designed studies on pharmacokinetics and pharmacodynamics. Their goal has to be comparing their bioavailability in the presence or absence of foods with the clinical response. In the meanwhile, to establish recommendations for their administration in relation to foods is inconsistent for some of these drugs and their results is uncertain given the lack of studies based on the FDAbioequivalence dictamen.
Key words: Anti-tumor agents. Effects of foods. Oral chemotherapy. Pharmacokinetics. Systematic review.
Introducción
La administración de medicamentos durante las comidas, media hora antes y hasta una hora después de las mismas, puede ser causa de elevada variabilidad en la respuesta clínica por interacción entre los fármacos y los alimentos (iFA) o alguno de sus componentes1,2. Este proceso se inicia en alguna de las partes del tracto gastrointestinal y a veces se enmascara con la enfermedad o con otros tipos de interacción entre los fármacos que componen el tratamiento farmacológico, dificultando su verdadera interrelación con el riesgo de toxicidad o fracaso terapéutico. Por esta razón u otras que no alcanzamos a identificar, actualmente las iFA se siguen considerando de escaso interés clínico3,4.
La terapia antineoplásica oral (hormonal y citostática) representa que los casos incidentes aumenten año tras año hasta situarse en no menos del 15% de los pacientes tratados con esta terapéutica. La comodidad de estos regímenes para el paciente ambulatorio es una realidad porque no compromete el resultado clínico, pero no se debe olvidar que son fármacos de estrecho margen terapéutico, a menudo administrados en combinación con otros agentes de similares características y sujetos a iFA. Además, los regímenes de dosificación de estos medicamentos son, en su mayoría, más complejos que los manejados en la farmacoterapia convencional de modo que en un contexto ambulatorio, la auto-administración por el paciente o cuidador, sin una información y monitorización predeterminada, puede traducirse en una falta de adherencia a los mismos.
Los pacientes, en general, no presentan idéntica respuesta a un mismo tipo de iFA5 por lo que las modificaciones farmacocinéticas deben analizarse considerando la posibilidad de que algunos alimentos, al alterar la actividad de enzimas de trasporte o metabolizadores, modifiquen la respuesta antineoplásica a estos fármacos6. Por tanto, al igual que sucede con las interacciones fármaco-fármaco, la significación clínica de las iFA se manifiesta con elevada variabilidad, baja prevalencia (1% del total) y con gravedad escasa o nula en el 40% de los casos, moderada en un 50% y grave en menos del 10% de las iFA7.
Los estudios de biodisponibilidad son parte integrante en las fases tempranas del desarrollo clínico de medicamentos para administración oral, pero en el caso de los antineoplásicos orales, las iFA no están claramente definidas, clasificadas y caracterizadas8,9. Actualmente, se empieza a reconocer su importancia clínica, planteándose su estudio con la misma metodología que soporta los ensayos clínicos10,11 ya que proporciona la mejor evidencia científica en fases tempranas12,13. Lamentablemente, la información disponible sobre las más de trescientas iFA o interacciones fármaco-alimento descritas, no se fundamenta sobre este grado de evidencia14-16.
En este trabajo se plantea una revisión sistemática sobre las iFA con medicamentos antineoplásicos orales a la vez que identifica el grado de evidencia científica disponible; su objetivo es alcanzar a poder recomendar la administración oral de estos medicamentos con alimentos, sin alimentos o indistintamente, desde la información publicada y revisada.
Métodos
Tipo de estudio
Revisión sistemática de la evidencia científica disponible, desde enero de 1966 a marzo de 2008, relacionada con las iFA con antineoplásicos orales comercializados o en fase de investigación.
Bases de datos y búsqueda bibliográfica
Se realizó la búsqueda bibliográfica a partir de la pregunta "iFA con los antineoplásicos orales comercializados" en las bases de datos Medline y The Cochrane Library. Como palabras clave se utilizaron: "antineoplastic agents, food effect, oral chemotherapy, food-drug interaction, pharmacokinetics".
Antes de aplicar los criterios de selección de artículos se establecieron dos fases. La primera fase tuvo como objetivo seleccionar sólo los artículos que, por título y contenido del resumen, se correspondían con la pregunta de investigación. En la segunda fase, se eliminaron las referencias duplicadas al reunir las referencias de las dos fuentes manejadas.
Criterios de selección de los artículos
Inclusión:
1. Tipo de estudios:
a) Revisiones sistemáticas.
b) Metaanálisis.
c) Ensayos clínicos randomizados (Fase I y II).
2. Población de pacientes:
a) Pacientes adultos (> 19 años de edad).
3. Intervenciones a comparar:
a) Administración de antineoplásicos orales bajo condiciones de ayuno o con alimentos.
4. Medida de resultado:
a) Cálculo del IC90% de la razón entre la media geométrica de valores de ABC y Cmax con alimentos y en condiciones de ayuno.
Exclusión
1. Publicaciones que como medida de resultado no hacían referencia al dictamen de bioequivalencia establecido por la FDA17; esto es, los límites (superior e inferior) del intervalo de confianza de la razón entre la media geométrica de valores de ABC o Cmáx, con alimentos y en condiciones de ayuno, han de estar comprendidos entre 0,8-1,25, para valores logotransformados (escala semilogarítmica) porque no es posible establecer la presencia de iFA, ni su relevancia clínica o bioinequivalencia.

Evaluación crítica de los estudios seleccionados
Se ha realizado la valoración crítica de los artículos seleccionados según las recomendaciones que, de acuerdo con la FDA17, deben cumplir estos estudios (Anexo 1).
Resultados
La búsqueda bibliográfica proporcionó 850 referencias (98,5% (838) Medline + y 1,4% (12) Cochrane). En la primera fase de revisión se excluyeron el 87,7% (746) de los artículos, correspondiendo el 100% a la búsqueda procedente de Medline. Durante la segunda fase fueron eliminadas las referencias duplicadas en ambas bases de datos. El resultado final de la búsqueda bibliográfica (tabla I) fue de sólo 40 artículos (5,2% de los iniciales) que se sometieron a lectura crítica a texto completo. A este proceso se añadieron 4 artículos más no indexados en Medline.
La lectura completa de los 44 trabajos seleccionados permitió identificar 25 referencias (20 artículos originales, 4 comunicaciones cortas y 1 metanálisis), que como medida del resultado en la población de estudio no consideraban el dictamen de bioequivalencia por lo que finalmente fueron excluidos. En la tabla II se recogen algunas de las características más destacables de los 19 artículos restantes (2,2% del total de la búsqueda inicial) que cumplen los criterios de inclusión predeterminados en este trabajo de revisión.
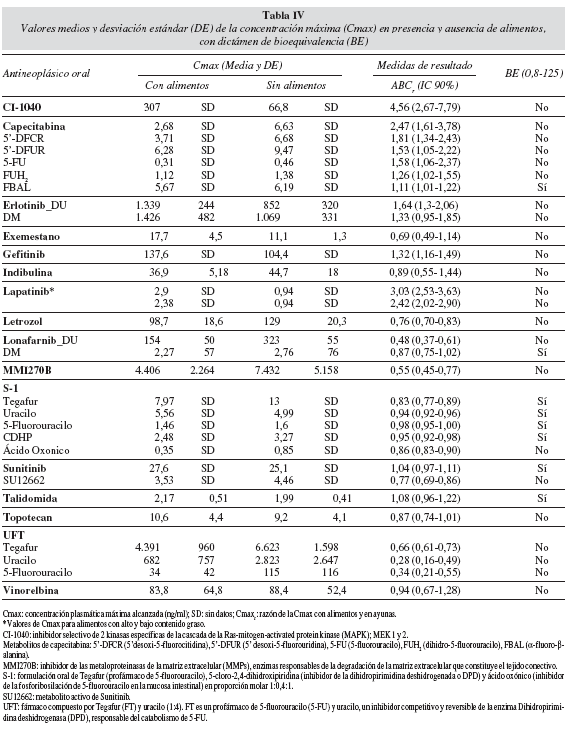
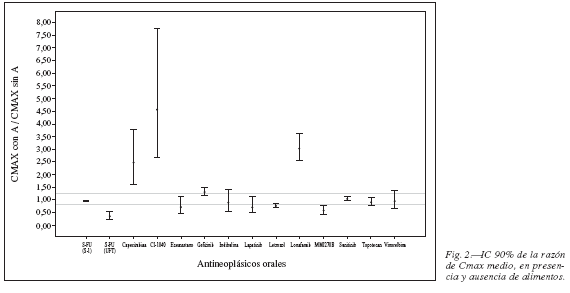
En los 19 trabajos seleccionados se han totalizado 19 fármacos antineoplásicos orales diferentes que han sido ensayados en una población de 250 pacientes con cáncer y 146 voluntarios sanos. En la tabla III se recogen los valores medios y desviación estándar para el ABC y, en la tabla IV se incluyen estos mismos datos para la Cmax. En ambos casos se ha considerado la presencia o ausencia de alimentos. Se incluye el dictamen de bioequivalencia para los 19 antineoplásicos orales estudiados. De los 25 artículos excluidos es relevante destacar que un 63,6% de las publicaciones (n = 14) cuantifican la presencia de iFA mediante el cálculo del porcentaje de cambio en los valores de referencia para ABC, Cmax y Tmax.
El resultado de la iFA de los antineoplásicos orales estudiados, en relación con el tipo de alimento y el cambio identificado respecto a los valores de referencia para ABC, Cmax y Tmax, expresado en porcentaje, se describe en la tabla V. Asimismo, se indican las recomendaciones expresadas para los diferentes antineoplásicos en los artículos seleccionados. Se evidencia que el 63% de estos fármacos estarían en "condiciones ideales" para su administración oral con o sin alimentos, indistintamente, porque no se modifican de manera significativa los valores medios de ABC y Cmax en ambas condiciones. El resto de los fármacos deben administrarse siguiendo una norma respecto a la ingesta de alimentos y así, hasta un 21% de estos fármacos se recomienda su administración con alimentos y un 16% sin alimentos.
Durante el proceso de lectura crítica se identificaron publicaciones que a pesar de establecer la influencia sobre los valores ABC y Cmax, en las condiciones de estudio con alimentos y sin alimentos, no había posibilidad de dictamen de bioequivalencia porque no disponían del IC 90% de la razón de los valores ABC y Cmax en las condiciones estudiadas. La información extraída respecto al tipo de alimento, contenido graso de los mismos y el porcentaje de cambio en los valores de referencia para ABC, Cmax y Tmax se describen en la tabla VI.
De los 19 fármacos antineoplásicos orales estudiados con el objetivo de establecer la presencia o ausencia de iFA, únicamente para el 42% se puede demostrar la condición de bioequivalencia; es decir, se cumple el criterio de que ambos límites (superior e inferior) del IC 90% del ABC están incluidos en el ámbito de valores 0,8 y 1,25. Para los 11 antineoplásicos restantes (58%) los estudios de iFA evidencian condición de bioinequivalencia; es decir, uno o los dos límites del IC 90% se sitúa por encima o por debajo del ámbito de valores aceptado para los IC90% de la razón de los parámetros medios de ABC (fig. 1) y Cmax (fig. 2) obtenidos en la situación "con o sin alimentos", para estos fármacos. Estas variaciones en el ABC o Cmax no parecen ser clínicamente determinantes ya que en la práctica asistencial no se utiliza el criterio de bioequivalencia para las iFA; tampoco parece existir evidencia para establecer el grado de correlación entre este dictamen y su respuesta en el paciente20.
Discusión
En los últimos años se ha incrementado el entusiasmo por el desarrollo de los agentes antineoplásicos vía oral, de nueva síntesis o a partir de fármacos parenterales ya comercializados18,19 dadas las implicaciones tanto clínicas como económicas de esta vía oral versus la vía parenteral. Pero el desarrollo de fármacos vía oral requiere un mayor conocimiento de los múltiples factores que pueden afectar a su biodisponibilidad: los alimentos, la dosis y cualquier otra medicación oral administrada concomitantemente.
El conocimiento de la biodisponibilidad de antineoplásicos orales proporciona ventajas como la recientemente propuesta por Mark y cols.20, de reducir cinco veces la dosis estándar de lapatinib cuando se administra con alimentos; esta condición no sólo disminuye el coste del tratamiento en un 80% sino la frecuencia y/o severidad de la diarrea dosis-dependiente secundaria a su administración. En consecuencia, es lógico que la detección e identificación de pacientes con oportunidades de mejora relacionadas con las iFA, sea uno de los estándares establecidos por la Joint Comision on Accreditation of Healthcare Organizations (JCAHO)21 a la vez que se reconoce la gran dificultad de su cumplimiento. A esta situación, contribuye, negativamente, el reciente informe de la American Society for Parenteral and Enteral Nutrition (ASPEN)22 y la Guía Clínica Canadiense23 sobre prácticas de seguridad en nutrición parenteral y enteral ya que no considera las iFA. Se está ante un estado de ignorancia respecto a la importancia clínica de las iFA que se traduce en un retraso en la potencial mejora asistencial de los pacientes en tratamiento con antineoplásicos orales.
En estas poblaciones de pacientes, cambios en el ABC o en las concentraciones plasmáticas en el ámbito de ± 10% pueden llegar a modificar la efectividad y seguridad del tratamiento. Sin embargo, como manifiestan algunos autores recogidos en esta revisión8,52, incrementos sustanciales en el ABC al administrar estos fármacos con alimentos, pueden no traducirse en modificaciones en la respuesta clínica. Así, para Exemestano, a pesar de observar incrementos del 39% en el ABC en presencia de alimentos, se garantiza el C50 o concentración inhibitoria estrogénica y por tanto la respuesta en el paciente. Lo mismo ocurre con Nilotinib, que a pesar de su absorción saturable y por tanto variable, las dosis establecidas garantizan concentraciones plasmáticas superiores al C50, necesarias para inhibir la fosforilación celular de BCR-ABL.
A pesar de las observaciones establecidas para Exemestano y Nilotinib, sería necesario estudiar la relación concentración-eficacia/seguridad para evaluar el alcance clínico de los resultados farmacocinéticos obtenidos, tal y como se apunta en el estudio de Capecitabina31 De hecho, otros autores demuestran que reducciones en los valores de los parámetros farmacocinéticos básicos, en presencia de alimentos, pueden llegar a disminuir la efectividad del tratamiento; esto sucede para el UFT (tegafur/uracil/fluorouracil) con Leucovorin cuya administración con alimentos reduce un 37% la exposición sistémica a 5-Fluorouracil, disminuyendo su actividad antitumoral34.
Las situaciones descritas demuestran que establecer un procedimiento normalizado para abordar las iFA no es tarea fácil porque los cambios en los parámetros farmacocinéticos básicos por iFA, no parecen relacionarse de forma universal con cambios idénticos en la respuesta clínica en los pacientes. La gran variabilidad interindividual del ABC, de hasta el 200% en el caso de gefitinib, exige evaluar cada paciente y considerar la influencia de la iFA en el ámbito terapéutico del fármaco implicado y la magnitud de la respuesta en términos de potencialidad de fracaso terapéutico en el mismo. Pero esta respuesta, medida a través del perfil de efectos adversos observados28 no presenta el mismo significado clínico real que en términos de supervivencia en el paciente y por ello, para algunos antineoplásicos orales se concluyen diferentes recomendaciones respecto a su ingesta o no con alimentos, a pesar de que las iFA hayan provocado cambios en el ABC del mismo orden de magnitud7,36; es decir, se emiten recomendaciones que anteponen el criterio de tolerancia al criterio de bioequivalencia. Es el caso de vinorelbina10, que a pesar de la reducción significativa de su biodisponibilidad (18%) en presencia de alimentos de alto contenido graso, al disminuirse la probabilidad de vómitos, prevalece este criterio frente a la reducción potencial de su respuesta. Algo similar ocurre con Lonafarnib24 en régimen de dosis múltiples, que pese a la situación de bioequivalencia en presencia y ausencia de alimentos, muestra una mayor incidencia de diarrea y desórdenes metabólicos en condiciones de ayuno (47% vs 22%).
La biodisponibilidad de los distintos componentes antineoplásicos formulados en una misma forma de dosificación, es afectada de manera diferente por la presencia o ausencia de alimentos. En este sentido, Godofridus y col36, estudian el efecto de S-1, una formulación oral de tegafur (profármaco de 5-fluorouracilo), 5-cloro-2,4-dihidroxipiridina (CDHP, inhibidor de la dihidropirimidin deshidrogenada) y ácido oxónico (inhibidor de la fosforibosilación de 5-Fluorouracilo que se acumula en la mucosa gastrointestinal, previniendo la formación de metabolitos tóxicos del mismo) en proporción molar 1:0,4:1. Los autores demuestran que la ingesta del fármaco junto con alimentos afecta únicamente a la farmacocinética del ácido oxónico, pero no a la de tegafur, CDHP y 5-fluorouracilo. En este caso se antepone el criterio de bioequivalencia obtenido al recomendar la administración de esta formulación con alimentos y animando al futuro desarrollo de estudios encaminados a reducir la toxicidad gastrointestinal de estos fármacos.
El estado actual de conocimiento clínico de las iFA sobre los antineoplásicos orales permite destacar que su importancia clínica se identifica y se orienta hacia la seguridad del paciente, dejando en un segundo plano la efectividad del tratamiento en el paciente. Esta percepción profesional, ante el lógico avance de estos tratamientos orales, sus elevados costes mensuales de miles de euros y las potenciales consecuencias clínicas de las iFA, exigen el planteamiento de estudios farmacocinéticos bien diseñados que comparen su biodisponibilidad en ayunas o en presencia de alimentos. Mientras tanto, indicar a los pacientes si deben tomar el medicamento con alimentos, sin alimentos o indistintamente es, para algunos de fármacos, inconsistente y de resultado incierto porque la mayoría de las recomendaciones no están basadas en el IC90% de la razón de los valores de ABC y/o Cmax obtenidos con sujetos sanos o pacientes en las dos condiciones estudiadas (con alimentos y sin alimentos).
Referencias
1. Chan LN. Drug-Nutrient Interactions. In Shil (Shils) ME, Shike M, Ross Caballero B, Cousins RJ eds. Modern Nutrition in health and disease. 10th ed. Philadelphia, PA. Lippincott Williams & Wilkins 2006: 1539-1553. [ Links ]
2. Charity D. Scripture and William D. Figg. Drug interactions in cancer therapy. Nature Rev Cancer 2006; 6: 546-558. [ Links ]
3. Boutalla JI, Barber JR. A perspective on drug-nutrient interactions. In Boutalla JI, Armenti VA, eds. Handbook of drug-nutrients interactions. Totowa, NJ: Humana Press 2004: 3-25. [ Links ]
4. Santos CA, Boullata JI. An approach to evaluating drug-nutrient interactions. Pharmacotherapy 2005; 25 (12): 1789-1800. [ Links ]
5. Zhang L, Strong JM, Oiu W, Lesko LJ, and Huang SM. Scientific Perspectives on drug transporters and their role in drug interactions. Mol Pharm 2005; 3 (1): 62-69. [ Links ]
6. Singh BN, Malhotra BK, Effects of food on the clinical pharmacokinetics of anticancer drugs. Underlying mechanism and implications for oral chemotherapy. Clin Pharmacokinet 2004; 43 (15): 1127-1156. [ Links ]
7. Jefferson JW. Drug and diet interactions: avoiding therapeutics paralysis. J Clin Psychiatric 1998; 59: 31-39. [ Links ]
8. Couris RR, Tataronis GR, Dallal GE, Blumberg JB, Dwyer JT. Assesment of healthcare professionals' knowledge about warfarin-vitamin k drug-nutrient interactions. J Am Coll Nutr 2000; 19 (4): 439-445. [ Links ]
9. Teresa ME, Morgan DE y cols. Attitudes of healthcare professionals toward patient counselling on drug-nutrient interactions. Ann Pharmacother 1994; 28: 576-580. [ Links ]
10. Bugat R, Variol P, Roche H, Fumoleau P, Robinet G, Senac I. The effects of food on the pharmacokinetic profile of oral vinorelbine. Cancer Chemother Pharmacol 2002; 50: 285-290. [ Links ]
11. Valle M, Di Salle E, Jannuzzo MG, Poggesi I, Rocchetti M, Spinelli R, Verotta D. A predictive model for exemestane pharmacokinetics/pharmacodynamics incorporating the effect of food and formulation. British Journal of Clinical Pharmacology 2005; 59 (3): 355-364. [ Links ]
12. Kuppens IE, Witteven PO, Witteveen PO, Schot M, Schuessler VM, Daehling A, Beijnen JH, Voest EE, Schellens JH. Phase I dose- finding and pharmacokinetic trial of orally administered indibulin (D-24851) to patients with solid tumors. Invest New Drugs 2007; 25 (3): 227-235. [ Links ]
13. Anderson D, Shelley S, Shelley S, Kellett N, Marshall D, Nimmo W. The Effect of Nateglinide Taken with Food on Gastric Emptying Rates in Healthy Subjects. Clin Therapeutics 2003; 25 (6): 1722-1738. [ Links ]
14. Pronsky Z. Food Medications interactions. 14th edition 2006. Birchrunville, PA. [ Links ]
15. Jiménez Torres, NV, Merino San Juan, M, Jiménez Torres NV, Merino Sanjuán M, Ordovás Baines JP, Casabó Alós V. Interacciones entre alimentos y medicamentos: bases farmacoterapéuticas. Primera edición 1999. Ed. Nutricia. Madrid. [ Links ]
16. www.medinteract.net (septiembre 2007). [ Links ]
17. Guidance for Industry. Bioavailability and bioequivalence studies for orally administered drug products-General considerations. Biopharmaceutics . CDER. FDA. March 2003. USA. [ Links ]
18. De Mario MD, Ratain MJ. Oral chemotherapy: Rationale and future directions. J Clin Oncol 1998; 16: 2557-2567. [ Links ]
19. Parsad SD, Ratain MJ. Prescribing oral chemotherapy: BMJ 2007; 334: 376. [ Links ]
20. Ratain MJ, Cohen EE. The Value Meal: How to Save 1,700 Per Month or More on Lapatinib. J Clin Oncol 2007; 25 (23) (August 10). [ Links ]
21. http://www.jointcommission.org/Standard (Acceso 30 octubre de 2007). [ Links ]
22. Jain MK, Heyland D, Dhaliwal R, Day AG, Drover J, Keefe L, Gelula M. Dissemination of the Canadian clinical guidelines for nutrition support: results of a cluster randomised controlled trial. Crit Care Med 2006; 34 (9): 2362-2369. [ Links ]
23. Seres D, Sacks GS, Pedersen CA, Canada TW, Johnson D, Kumpf V. Parenteral Nutrition Safety Practices: Results of the 2003 American Society for Parenteral and Enteral Nutrition Survey. J Parenter Enteral Nutr 2006; 30 (3): 259-265. [ Links ]
24. Zhu Y, Statkevich P, Zhu Y, Statkevich P, Cutler DL. Effect of food on the pharmacokinetics of lonafarnib (SCH 66336) following single and multiple doses. Int J Clin Pharmacol Ther 2007; 45 (10): 539-547. [ Links ]
25. Cockshott ID, Oliver SD, Young JJ, Cooper KJ, Jones DC. The effect of food on the pharmacokinetics of the bicalutamide ("Casodex") enantiomers. Biopharm Drug Dispos 1997; 18 (6); 499-507. [ Links ]
26. Sioufi A, Sandrenan N, Godbillon J, Trunet P, Czendlik C, Howald H, Pfister Ch, Ezzet F. Comparative bioavailability of letrozol under fed and fasting conditions in 12 healthy subjects after a 2,5mg single oral administration. Biopharm Drug Dispos 1997; 18 (6): 489-497. [ Links ]
27. Teo SK, Scheffler MR, Kook KA, Tracewell WG, Colburn WA, Stirling DI, Thomas SD. Effect of a high-fat meal on thalidomide pharmacokinetics and the relative bioavailability of oral formulations in healthy men and women. Biopharm Drug Dispos 2000; 21 (1): 33-40. [ Links ]
28. Swaisland H, Smith RP, Laight A, Kerr DJ, Ranson M, Wilder-Smith CH, DuvABChelle T. Single-Dose clinical pharmacokinetic studies of Gefitinib. Clin Pharmacokinet 2005; 44 (11): 1165-1177. [ Links ]
29. Bello C, Sherman L, Zhou J, Verkh L, Smeraglia J, Mount J, Klamerus KJ. Effect of food on the pharmacokinetics of sunitinib malate (SU11248), a multi-targeted receptor tyrosine kinase inhibitor: results from a phase I study in healthy subjects. Anti-Cancer Drugs 2006; 17: 353-358. [ Links ]
30. Ling J, Fettner S, Lum B, Riek M, Rakhit A. Effect of food on the pharmacokinetics of erlotinib, an orally active epidermal growth factor receptor tyrosine-kinase inhibitor, in healthy individuals. Anti-Cancer Drugs 2008; 19: 209-216. [ Links ]
31. Reigner B, Verweij J, Verweij J, Dirix L, Cassidy J, Twelves C, Allman D, Weidekamm E, Roos B, Banken L, Utoh M, Osterwalder B. Effect of food on the pharmacokinetics of capecitabine and its metabolites following oral administration in cancer patients. Clin Cancer Res 1998; 4 (4): 941-948. [ Links ]
32. Herben VMM, Rosing H, Huinink BWW, Van Zomeren DM, Batchelor D, Doyle E, Beusenberg FD, Beijnen JH, Schellens JH. Oral Topotecan: bioavailability and effect food co-administration. Br J Cancer 1999; 80 (9): 1380-1386. [ Links ]
33. Eskens FA, Levitt NC, Sparreboom A, Choi Les, Mather R, Verweij J, Harris AL. Effect of Food on the Pharmacokinetics of Oral MMI270B (CGS27023A), a Novel Matrix Metalloproteinase Inhibitor. Clin Cancer Res 2000; 6: 431-433. [ Links ]
34. Damle B, Ravandi F, Kaul S, Sonnichsen D, Ferreira I, Brooks D, Stewart D, Alberts D, Pazdur R. Effect of food on the oral bioavailability of UFT and leucovorin in cancer patients. Clin Cancer Res 2001; 7 (3): 517-523. [ Links ]
35. Shepard D, Mani S, Shepard DR, Mani S, Kastrissios H, Learned-Coughlin S, Smith D, Ertel P,Magnum S, Janisch L, Fleming GF, Schilsky RL, Ratain MJ. Estimation of the effect of food on the disposition of oral 5-fluorouracil in combination with eniluracil. Cancer Chemother Pharmacol 2002; 49 (5): 398-402. [ Links ]
36. Peters GJ, Noordhuis P, Van Groeningen CJ, Giacconeg G, Holwerda U, Voorn D, Schrijvers A, Schornagel JH, Beijnen JH, Fumoleau P, Schellens JHM . The Effect of Food on the Pharmacokinetics of S-1 after Single Oral Administration tro Patients with Solid Tumors. Clin Cancer Res 2004; 10: 4072-4076. [ Links ]
37. Lorusso PM, Adjei AA, Varterasian M, Gadgeel S, Reid J, Mitchell DY, Hanson L,DeLuca P, Bruzek L, Piens J, Asbury P, Van Becelaere K, Herrera R, Sebolt-Leopold J, Meyer MB. Phase I and pharmacodynamic study of the oral MEK inhibitor CI-1040 in patients with advanced malignancies. J Clin Oncol 2005; 23 (23): 5281-5293. Epub 2005 Jul 11. [ Links ]
38. Soepenberg O, Dumez H, Verweij J, de Jong FA, de Jonge MJ, Thomas J, Eskens FA, van Schaik RH, Selleslach J, Ter Steeg J, Lefebvre P, Assadourian S, Sanderink GJ, Sparreboom A, van Oosterom AT. Phase I pharmacokinetic, food effect, and pharmacogenetic study of oral irinotecan given as semisolid matrix capsules in patients with solid tumors. Clin Cancer Res 2005; 1 (4): 1504-1511. [ Links ]
39. Kuppens IELM, Witteveen PO, Schot M, Schuessler VM, Daehling A, Beijnen JH, Voest EE, Schellens JHM. Phase I dose-finding and pharmacokinetic trial of orally administered indibulin (D-24851) to patients with solid tumors. Invest New Drugs 2007; 25: 227-235. [ Links ]
40. Reddy N, Cohen R, Whitehead B, Kosch K, Stead A, Beelen A, Lewis L. A phase I, open-label, three period, randomized, crossover study to evaluate the effect of food on the pharmacokinetics of lapatinib in cancer patients. Clin Pharmacokinet Ther 2007; 81: S16-S17. [ Links ]
41. Rugo HS, Herbst RS, Liu G, Park JW, Kies MS, Steinfeldt HM, Pithavala YK, Reich SD, Freddo JL, Wilding G. Phase I Trial of the Oral Antiangiogenesis Agent AG-013736 in Patients With Advanced Solid Tumors: Pharmacokinetic and Clinical Results. J Clin Oncol 2005; 23 (24): 5474-5483. [ Links ]
42. Berlin J, Tutsch KD, Arzoomanian RZ, Alberti D, Binger K, Feierabend C, Dresen A, Marnocha R, Pluda J, Wilding G. Phase I and pharmacokinetic study of a micronized formulation of carboxyamidotriazole, a calcium signal transduction inhibitor: toxicity, bioavailability and the effect of food. Clin Cancer Res 2002; 8 (1): 86-94. [ Links ]
43. Albertioni F, Juliusson G, Liliemark J. On the bioavailability of 2-chloro-2'-deoxyadenosine (CdA). The influence of food and omeprazole. Eur J Clin Pharmacol 1993; 44 (6): 579-582. [ Links ]
44. Ehrsson H, Wallin I, Simonsson B, Hartvig P, Oberg G. Effect of food on pharmacokinetics of chlorambucil and its main metabolite, phenylacetic acid mustard. Eur J Clin Pharmacol 1984; 27 (1): 111-114. [ Links ]
45. Calvo E, Tolcher AW, Hammond LA, Patnaik A, de Bono JS, Eiseman IA, Olson SC, Lenehan PF, McCreery H, Lorusso P, Rowinsky EK. Administration of CI-1033, an irreversible panerbB tyrosine kinase inhibitor, is feasible on a 7-day on, 7-day off schedule: a phase I pharmacokinetic and food effect study. Clin Cancer Res 2004; 10 (21): 7112-7120. [ Links ]
46. Gunnarsson PO, Davidsson T, Anderson SB, Backman C, Johansson SA. Impairment of estramustine phosphate absortion by concurrent intake of milk and food. Eur J Clin Pharmacol 1990; 38: 189-193. [ Links ]
47. Oscier D, Orchar JA, Culligan D, Cunningham D, Johnson S, Parker A, Klein M, Gieschen H. The bioavailability of oral fludarabine phosphate is unaffected by food. The Haematology Journal 2001; 2: 316-321. [ Links ]
48. Swaisland H, Laight A, Stafford L, Jones H, Morris C, Dane A, Yates R. Pharmacokinetics and Tolerability of the Orally Active Selective Epidermal Growth Factor Receptor Tyrosyne Kinase Inhibitor ZD1839 in Healthy Volunteers. Clin Pharmacokinet 2001; 40 (4): 297-306. [ Links ]
49. Peng B, Lloyd P, Schran H. Clinical pharmacokinetic of imatinib. Clin Pharmacokinet 2005; 44 (9): 879-894. [ Links ]
50. Reece PA, Kotasek D. The effect of food on oral melphalan absorption. Cancer Chemother Pharmacol 1986; 16 (2): 194-197. [ Links ]
51. Bosanquet AG, Gilby ED. Comparison of the fed and fasting states on the absorption of melphalan in multiple myeloma. Cancer Chemother Pharmacol 1984; 12 (3): 183-186. [ Links ]
52. Tanaka C, Smith T, Kantarjian H, Giles F, Ottmann O, Bhalla K, Grouss K, Sethuraman V, Thomas K, Schran H. Clinical pharmacokinetics (PK) of AMN107, a novel inhibitor of Bcr-Abl, in healthy subjects and patients with imatinib resistant or intolerant chronic myelogenous leukemia (CML) or relapsed/refractory Ph+ acute lymphocytic leukemia (Ph+ALL). JCO, 2006 ASCO Annual Meeting Proceedings Part I. Vol 24, No. 18S (June 20 Supplement), 2006: 3095. [ Links ]
53. Zamboni WC, Goel S, Iqbal T, Parise RA, Strychor S, Repinski TV, Egorin MJ, Mani S. Clinical and pharmacokinetic study evaluating the effect of food on the disposition of 9-nitrocamptothecin and its 9-aminocamptothecin metabolite in patients with solid tumors. Cancer Chemother Pharmacol 2006; 57 (5): 631-639. [ Links ]
54. Hughes AN, Rafi I, Griffin MJ, Calvert AH, Newell DR, Calvete JA, Johnston A, Clendeninn N, Boddy AV. Phase I Studies with the Nonclassical Antifolate Nolatrexed Dihydrochloride (AG337, THYMITAQ) Administered Orally for 5 Days. Clin Cancer Res 1999; 5: 111-118. [ Links ]
55. Hoekstra R, Dumez H, Eskens FA, Van der Gaast A, Planting AS, de Heus G, Sizer KC, Ravera C, Vaidyanathan S, Bucana C, Fidler IJ, van Oosterom AT, Verweij J. Phase I and pharmacologic study of PKI166, an epidermal growth factor receptor tyrosine kinase inhibitor, in patients with advanced solid malignancies. Clin Cancer Res 2005; 11 (19 Pt 1): 6908-6915. [ Links ]
56. Rubin EH, Agrawal NG, Friedman EJ, Scott P, Mazina KE, Sun L, Du L, Ricker JL, Frankel SR, Gottesdiener KM, Wagner JA, Iwamoto M. A study to determine the effects of food and multiple dosing on the pharmacokinetics of vorinostat given orally to patients with advanced cancer. Clin Cancer Res 2006; 12 (23): 7039-7045. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Nicolás Víctor Jiménez Torres.
Servicio de Farmacia. Hospital Universitario Dr. Peset.
Avda. Gaspar Aguilar, 90.
46017 Valencia.
E-mail: jimenez_vic@gva.es
Recibido: 18-IX-2008.
Aceptado: 2-II-2009.