INTRODUCCIÓN
El tratamiento endovascular de los aneurismas de aorta (EVAR) ha aumentado en frecuencia y disponibilidad a lo largo de todo el mundo, y lo mismo ha sucedido con el uso de dispositivos fenestrados (FEVAR) y ramificados (BEVAR) para el tratamiento de los aneurismas de aorta yuxtarrenales (AAYR) y abdominotorácicos (AATA) debido a su demostrada menor morbimortalidad perioperatoria en comparación con la cirugía abierta (1). Es cierto que el cuello proximal ha sido siempre la zona de mayor relevancia a la hora de planificar el tratamiento de un aneurisma de aorta por las graves complicaciones que puede ocasionar, pero el acceso también puede significar un gran problema (2). Tanto las oclusiones, las estenosis o el pequeño calibre como la calcificación y la tortuosidad de las arterias ilíacas pueden ser grandes factores limitantes a la hora de planificar estos procedimientos e incluso pueden ser causa de complicaciones que aumentan la morbimortalidad. Si bien se dice que la frecuencia de las complicaciones de acceso no es muy alta en casos de EVAR estándar, su mortalidad es alta y además es posible que su frecuencia en realidad esté infrarregistrada, ya que algunas series reportan complicaciones vasculares intraoperatorias cercanas al 10 % (3). Asimismo, también está demostrado su impacto negativo a largo plazo, especialmente en mujeres (2,4). Las series más grandes sobre FEVAR y BEVAR demuestran aumentos en la morbimortalidad por complicaciones de acceso, fundamentalmente por isquemia de miembros inferiores, en comparación al EVAR estándar. Todo esto puede explicarse debido al mayor tiempo operatorio y al uso de dispositivos de mayor calibre (5).
El amplio uso en el mundo de los dispositivos de cierre percutáneo ha desplazado parcialmente a la exposición abierta, dado que incluso algunas publicaciones hablan de triple riesgo de complicaciones en pacientes que reciben una incisión (5,6). Sin embargo, el costo es otro factor que influye a la hora de decidirse por un abordaje percutáneo o uno abierto (4).
El uso de conductos iliofemorales se describió hace más de 20 años, inicialmente a través de un abordaje retroperitoneal, con el objetivo de ampliar la aplicabilidad del EVAR (7,8). Algunas publicaciones hablan de una mayor morbimortalidad asociada al uso de conductos iliofemorales (9), mientras que otras afirman que determinados pacientes podrían beneficiarse de su uso (10,11). Sin embargo, la evidencia disponible sobre su uso en EVAR complejo es limitada (12,13). Se sabe que el FEVAR y el BEVAR son procedimientos de mayor complejidad y, por tanto, conllevan un mayor riesgo de complicaciones. Además, la población de pacientes es más mórbida en comparación a la de los pacientes que reciben un EVAR estándar (12).
Este trabajo tiene como objetivo analizar el impacto en nuestra práctica del uso de conductos en la morbimortalidad neurológica y vascular asociada a FEVAR y BEVAR.
MATERIALES Y MÉTODOS
Se realizó una recolección retrospectiva de pacientes que recibieron FEVAR o BEVAR en forma electiva entre 2014 y 2020 en una sola institución (Clínica La Sagrada Familia, Buenos Aires, Argentina). Se incluyeron solo pacientes operados mediante FEVAR o BEVAR por aneurismas yuxtarrenales, abdnominotorácicos o endoleak IA desde el año 2014, debido a que fue desde entonces que comenzamos a utilizar conductos, con seguimiento a 30 días. No se incluyeron pacientes que hubieran recibido conductos para EVAR estándar, TEVAR o CHEVAR, como tampoco aneurismas rotos u otros casos operados de urgencia. Los pacientes se dividieron en dos grupos: uno, en el que se utilizaron conductos (grupo A) y otro, en los que no (grupo B). A su vez, el grupo A se subdividió entre aquellos que recibieron un conducto temporal y aquellos que recibieron uno permanente. Se analizaron variables demográficas, como la hipertensión arterial (HTA), el tabaquismo o el extabaquismo (TBQ o ex-TBQ), la enfermedad pulmonar obstructiva crónica (EPOC), la dislipidemia (DLP), la diabetes (DBT), la insuficiencia renal crónica (IRC), la enfermedad coronaria (EC), la enfermedad vascular periférica (EVP), stroke, la fibrilación auricular (FA) o la cirugía aórtica previa (abierta o endovascular). También se recolectó otra información, como el diámetro del aneurisma, los días de ingreso, el tiempo operatorio, el tipo de dispositivo utilizado (Custom-Made Device [CMD], Physician-Modified EndoGraft [PMEG] u Off The Shelf [OTS]), el tamaño del dispositivo (Fr), la necesidad de transfusión de glóbulos rojos sedimentados (GRS), la cantidad de vasos tratados, el tipo de conducto (temporal o permanente), el tiempo transcurrido entre la confección del conducto permanente y el FEVAR o el BEVAR (según aplicase), la presencia de complicaciones y la mortalidad perioperatoria (30 días). Todos los pacientes recibieron una angiotomografía preoperatoria y las mediciones se realizaron de adventicia a adventicia en línea central de manera ortogonal con OsiriX Lite (V 12.0) (Fig. 1).
DESCRIPCIÓN TÉCNICA
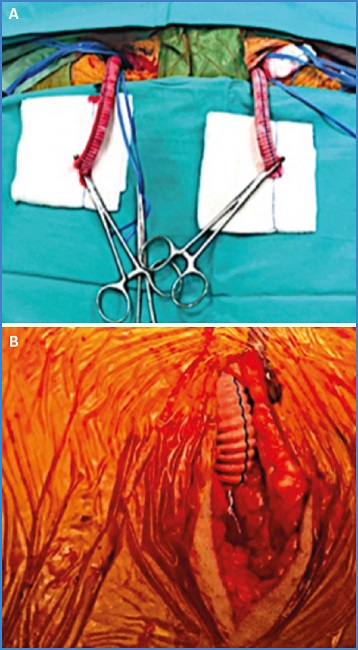
Los conductos temporales consisten en que, una vez expuesta la arteria femoral común, hay que anastomosar en su cara anterior un segmento de 10 cm de una prótesis de poliéster de 10 mm de manera lateroterminal y mantener pinzado el otro extremo durante toda la cirugía. Una vez hecho esto, en lugar de punzar la arteria para ganar acceso, punzamos el conducto. Las ventajas de esta técnica son varias.
Por un lado, es que en ningún momento después de la confección del conducto uno vuelve a pinzar las arterias femoral común, superficial o profunda y, por tanto, se reducen los tiempos y la cantidad de isquemia de miembros inferiores a los que se somete al paciente. Por otra parte, durante cada intercambio de dispositivo o introductor el miembro recibe flujo anterógrado. Asimismo, en caso de prolongarse el procedimiento más de lo esperado, simplemente retirando el introductor o el dispositivo hasta el conducto en sí (fuera de la arteria) uno puede reperfundir de forma inmediata el miembro en cuestión el tiempo que desee y luego continuar. También se evita la situación de tener que reparar el vaso al final del procedimiento mediante un parche o un bypass, lo que también prolonga los tiempos de isquemia, ya que al finalizar el procedimiento simplemente se retiran los dispositivos y se cierra un muñón de prótesis (Fig. 1A). Se utilizaron en casos en los que esperábamos un tiempo operatorio más prolongado de lo habitual o en pacientes con arteriopatía periférica.
Los conductos permanentes son casos en los que se efectuó un bypass propiamente dicho (ilíaco-femoral o aortobifemoral), ya sea por presencia de enfermedad oclusiva o por arterias de pequeño calibre. Al igual que con los conductos temporales, cumplen la función de canal de trabajo, mientras que el miembro jamás deja de perfundirse a través de los vasos nativos (ya sea por flujo directo o colateral) (Fig. 1B). Los candidatos a esta alternativa fueron todos aquellos con enfermedad oclusiva del eje ilíaco (uni- o bilateral) o con calibre de ilíacas externas inferior a 6 mm.
ANÁLISIS ESTADÍSTICO
Se utilizó como software Rstudio Team (2020) (Rstudio: Integrated Development for R. Studio, PBC, Boston, Massachusetts, EE. UU.). Las variables cuantitativas se expresaron como promedio y desvío estándar, mientras que las cualitativas lo fueron mediante frecuencias y porcentajes. Las comparaciones entre grupos se analizaron mediante test t o χ2, según correspondiera. Se tomó como significativo un valor p < 0,05.
RESULTADOS
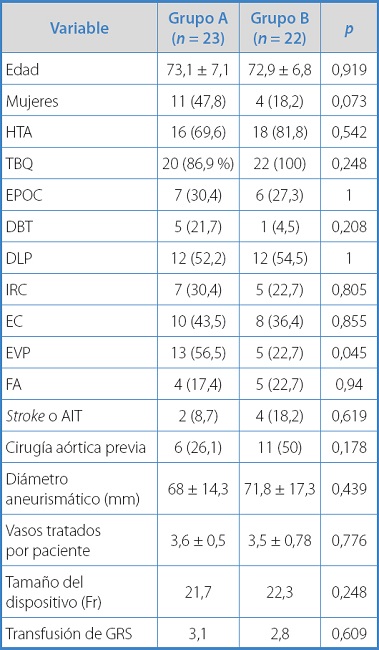
Entre 2014 y 2020, 45 pacientes recibieron FEVAR o BEVAR por aneurismas de aorta yuxtarrenales, abdominotorácicos o endoleak IA. 23 pacientes recibieron conductos (grupo A) mientras que otros 22 no (grupo B). La media de edad fue 73 ± 7,1 años (grupo A, 73,1 años; grupo B, 72,9 años) y el diámetro medio del saco aneurismático fue de 69,9 ± 15,9 mm (grupo A, 68 mm frente a grupo B, 71,8 mm; p = 0,439). El grupo A presentó una mayor proporción de mujeres, aunque estas diferencias no fueron significativas (47 % frente a 18,2 %, p = 0,073). Sin embargo, el grupo A sí presentó una significativa mayor cantidad de pacientes portadores de EVP (56,5 % frente a 22,7 %, p = 0,045). Los datos clínicos y demográficos se muestran en la tabla I. La cantidad de AATA I-III fue similar en ambos grupos (A 65,2 % frente a B 50 %, p = 0,464).
La estancia hospitalaria media fue de 4,7 días (0,31) (grupo A, 3,9; grupo B, 5,5 días, p = 0,265). En total se trataron 159 vasos (108 fenestraciones y 51 ramas), 3,5 ± 0,7 por paciente. En el grupo A predominó el uso de PMEG (n = 13, 56,5 %, frente a n = 3, 13,6 %; p = 0,007), mientras que en el grupo B predominaron los CMD (n = 15, 68,2 %, frente a n = 6, 26,1 %; p = 0,011). No hubo diferencias significativas con respecto al tiempo operatorio (grupo A, 350,9 minutos, grupo B, 374,2 minutos; p = 0,593), como tampoco en cuanto al tamaño del dispositivo utilizado (grupo A, 21,7 Fr frente al grupo B, 22,3 Fr; p = 0,248). Sin embargo, los pacientes del grupo A presentaron diámetros de arterias ilíacas externas menores a los del grupo B (lado derecho, 6,9 mm frente a 8,5 mm, p < 0,001; lado izquierdo 6,6 mm frente a 8,6 mm, p < 0,001).
El uso de conductos aumentó notablemente a lo largo del periodo de estudio, que fue del 32 % para el periodo 2014-2017 frente al 75 % para el periodo 2018-2021 (p = 0,01) (Tabla I).
COMPLICACIONES
Ocho pacientes presentaron complicaciones en el perioperatorio (17,8 %; grupo A, n = 1, 4,3 %, frente al grupo B, n = 7, 31,8 %; p = 0,043). Estas se detallan en la tabla II. De estos pacientes, 2 fallecieron (ambos del grupo B), dejando una mortalidad perioperatoria del 4,4 % (grupo A, 0 %, frente al grupo B, 9,1 %; p = 0,45). Una de las muertes fue la de una mujer debido a un shock hemorrágico secundario a una ruptura de la arteria ilíaca externa (Fig. 2) y la otra fue la de un hombre debido a una isquemia aguda de miembro inferior con fallo multiorgánico secundario a síndrome de reperfusión (el primer día posoperatorio). Dos de los casos que tuvimos de isquemia medular se presentaron en mujeres: uno como paraparesia temprana reversible y el otro como paraplejia (paciente con conducto previo: bypass iliacofemoral y femorofemoral cruzado). El tercero fue un hombre del grupo B, que se presentó como paraparesia tardía, que también se revirtió. Esto dejó una tasa de isquemia medular del 4,3 % para el grupo A y del 9,7 % para el grupo B (p = 0,968). La segunda ruptura que tuvimos se diagnosticó y se reparó en el quirófano, mientras que los otros dos casos de isquemia se diagnosticaron (trombosis de arteria femoral común) y se repararon el primer día posoperatorio. Solo un paciente (del grupo B) requirió diálisis en forma permanente después de la cirugía y solo un paciente de los 8 que presentaron complicaciones neurológicas y vasculares en el perioperatorio sobrevivió 1 año (supervivencia a un año: 12,5 %).
CONDUCTOS
Las mujeres requirieron el uso de conductos con mayor frecuencia que los hombres (78,6 % frente a 29,3 %, p = 0,004). Dentro del grupo A, 12 pacientes (52,2 %) recibieron un conducto permanente mientras que otros 11 recibieron (47,8 %) uno temporal. El tiempo medio transcurrido entre la confección de los conductos permanentes y el FEVAR/BEVAR fue de 7,7 meses. Como es de esperar, aquellos pacientes con conductos permanentes presentaron mayor incidencia de EVP (91,7 % frente a 18,2 % en conductos temporales, p < 0,001, frente a 18,8 % para el resto de los pacientes, p < 0,001) (Fig. 3). No se registraron casos de hemorragias, infección, pseudoaneurismas, estenosis u oclusión de bypass. Un solo paciente desarrolló una linforrea de bajo débito, con cultivos negativos, que cerró espontáneamente a las dos semanas. La confección intraoperatoria de conductos no significó un mayor requerimiento de transfusión de GRS en comparación con los demás pacientes (2,5 frente a 3,1 unidades, p = 0,413).
DISCUSIÓN
Además del uso de conductos iliofemorales, existen diversas técnicas descritas para lidiar con la anatomía ilíaca desafiante, como las angioplastias, el uso de stents, la técnica pave and crack, endoconductos o el acceso directo de las arterias ilíacas o la aorta abdominal distal (4,14). La publicación de Schanzer y Greenberg de 2011 demostró que, entonces, en Estados Unidos, más de la mitad de los pacientes que recibían un EVAR no cumplían con las instrucciones para uso. De estos, más del 30 % poseía al menos una arteria ilíaca externa con un diámetro inferior a 6 mm (15). El registro EUROSTAR reporta complicaciones relacionadas al acceso en el 13 % de los pacientes. Estas son también una de las causas más frecuentes de conversión a cirugía abierta (16).
Hay diversas publicaciones que describen una mayor estancia hospitalaria, pérdida hemática y mortalidad a 30 días en pacientes que requieren conductos iliofemorales (9,17,18). Nuestra experiencia es muy distinta, incluso aunque nuestra serie es sobre F/BEVAR; sin embargo, es cierto que nosotros realizamos los conductos permanentes siempre en un procedimiento previo. De hecho, Rowse y cols. hablan de que el uso de conductos es seguro en pacientes que lo requieren y que deben realizarse preferentemente de manera electiva y en procedimientos separados (10). En esta publicación, reportan un 5,6 % de reintervención secundaria a sangrado y un paciente que presentó trombosis del bypass.
Si bien el grupo A presenta mayor proporción de mujeres (47,6 % frente a 18,2 %), uso de PMEG (52,4 % frente a 9,1 %) e incidencia de EVP (56,5 % frente a 22,7 %), los resultados perioperatorios son mejores en este grupo: no se registran muertes ni casos de isquemia de miembros inferiores y hay una menor tasa de isquemia medular. Por ello, sostenemos que el uso de conductos no solo es seguro en EVAR complejo cuando es parte de la planificación preoperatoria, sino que incluso ayuda a prevenir complicaciones neurológicas y vasculares y, por tanto, a reducir también la mortalidad perioperatoria. Se conoce la relación entre isquemia de miembros inferiores e isquemia medular. Haulon publicó un protocolo de prevención de isquemia medular que incluye reperfusión temprana de la circulación pélvica y de miembros inferiores (19).
Publicaciones muy recientes de Oderich y cols. hablan también sobre un mayor requerimiento del uso de conductos en mujeres con arteriopatía periférica, como también registran un 0 % de mortalidad a 30 días en estos pacientes frente al 1,2 % en pacientes en quienes no utilizaron conductos. A diferencia de nuestros resultados, sí reportan mayor estancia hospitalaria y requerimiento transfusional (20). En 2019 publicamos nuestro propio protocolo al respecto en pacientes con TEVAR, FEVAR y BEVAR. Dentro de los elementos, incluimos el uso de conductos como herramienta para restaurar de forma precoz el flujo sanguíneo de la pelvis y de los miembros inferiores. Ninguno de esos 29 pacientes registra eventos neurológicos o muerte (21).
No creemos que en nuestro caso sea factible realizar un estudio prospectivo sobre el tema dado que, tal como reflejan nuestros números, nuestra práctica ha adoptado en forma casi rutinaria el uso de conductos para cualquier EVAR en el que consideremos que se encuentra en riesgo aumentado de complicaciones neurológicas y/o vasculares de miembros inferiores.
Por supuesto que nuestro trabajo tiene limitaciones. La naturaleza retrospectiva del mismo limita la recolección de variables como pérdida hemática intraoperatoria, los cuales sería interesante conocer ya que creemos que el uso de conductos reduce significativamente la pérdida hemática.
CONCLUSIONES
El uso de conductos iliofemorales en FEVAR y BEVAR es seguro cuando forma parte de la planificación preoperatoria. Las complicaciones neurológicas y vasculares no son infrecuentes en estos pacientes y conllevan una alta mortalidad, pero el uso de conductos es efectivo para reducir su incidencia.