Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Intensiva
versión impresa ISSN 0210-5691
Med. Intensiva vol.33 no.6 ago./sep. 2009
PUESTA AL DÍA EN MEDICINA INTENSIVA: TRASPLANTES
Preservación de órganos
Organ preservation
José Luis Escalante Coboa, Francisco del Río Gallegosb
aPrograma de Trasplantes, Hospital General Universitario Gregorio Marañón, Madrid, España
bServicio de Medicina Intensiva, Coordinación de Trasplantes, Hospital Universitario San Carlos, Madrid, España
Dirección para correspondencia
RESUMEN
El mantenimiento de la viabilidad de los órganos desde su extracción hasta el trasplante es un factor crucial para la adecuada función y la supervivencia del injerto. En los últimos años, este proceso se ha convertido en un verdadero reto, ya que, como consecuencia de la escasez de donantes, se utilizan con mayor frecuencia donantes con criterios expandidos, en los que la funcionalidad del órgano está más afectada.
El daño de los órganos ocurre principalmente como resultado de la lesión por isquemiareperfusión, en relación con las lesiones derivadas de la propia preservación. Para minimizar este daño se usan diferentes técnicas de preservación de los órganos, cuyo objetivo es optimizar la función del órgano una vez que se restablezca la perfusión.
Por su extremada simpleza, la conservación en frío estática es el método de preservación más utilizado, ya que presenta una serie de ventajas, como su disponibilidad, casi universal, y su facilidad de transporte. Sin embargo, es cuestionable si este método es capaz de prevenir el deterioro de la calidad de los órganos del grupo de donantes con criterios expandidos. En este artículo se describen pormenorizadamente los métodos de preservación actuales, con especial énfasis en la utilización de las máquinas de perfusión continua.
Palabras clave: Preservación; Isquemia-reperfusión; Soluciones de preservación; Máquina de perfusión hipotérmica; Trasplante.
ABSTRACT
Maintaining organ viability from extraction to transplantation is crucial to ensure the function and survival of the graft. In recent years, maintaining organ viability has become more challenging because the shortage of donors has led to broader criteria for donor acceptability and consequently to organs with greater compromise.
Organ damage occurs primarily as a result of ischemia-reperfusion injury, which is associated to additional damage from the preservation process. To minimize this damage, different techniques of organ preservation are used with the aim of optimizing organ function once perfusion is restored.
Static cold storage is the most commonly used method of preservation because it is extremely simple, nearly universally available, and easy to transport. However, static cold storage may be unable to prevent the deterioration of the quality of organs from donors included under the broader criteria. In this article, we describe current preservation techniques; we place special emphasis on continuous machine perfusion.
Key words: Preservation; Ischemia-reperfusion; Preservation techniques; Hypothermic machine perfusion; Transplantation.
Introducción
En la segunda mitad del siglo XX, los trasplantes de órganos han supuesto una auténtica revolución en el mundo de la medicina y se han convertido en una actividad cotidiana en nuestros hospitales1. Baste decir que en la Unión Europea se realizan cerca de 30.000 trasplantes de órganos anuales, de los que casi 4.000 se llevan a cabo en España2.
Esto ha sido posible gracias a importantes avances en las técnicas quirúrgicas y de cuidados intensivos, el desarrollo de nuevos fármacos inmunosupresores y el perfeccionamiento de nuevas y mejores técnicas de preservación de órganos. Estas últimas han tenido un impacto decisivo en la viabilidad de los órganos y en el éxito del trasplante, lo que permite que la supervivencia de los injertos en el primer año se mantenga por encima del 90% para riñones, hígado, páncreas y corazón.
Sin embargo, en los últimos años, el mantenimiento de la viabilidad de los órganos durante la preservación se ha convertido en un verdadero reto, ya que, como consecuencia de la escasez de donantes, los criterios de inclusión del donante cadáver se han ampliado de forma muy importante. En la actualidad, los órganos se obtienen de donantes más mayores, con más enfermedades y en mayor número de donantes a corazón parado que los obtenidos hace 10 años.
En este artículo, se revisan los principales mecanismos fisiopatológicos, los principios y las técnicas actuales de preservación de órganos.
Fisiopatología y bases de la preservación de órganos
La extracción, el almacenamiento y el trasplante de un órgano sólido de un donante alteran significativamente la homeostasis del medio interno del órgano y sus efectos se manifestarán en el grado en que recupere o no su función tras el trasplante. La lesión del órgano ocurre principalmente como resultado de la isquemia, y las diferentes técnicas de preservación de órganos sirven para minimizar este daño y mejorar la función y la supervivencia del injerto.
Fases de las lesiones orgánicas durante el trasplante
El daño de los órganos durante el trasplante ocurre en dos fases. La primera, denominada fase de isquemia caliente, incluye el tiempo que pasa desde la interrupción de la circulación del órgano donado hasta el momento en que es perfundido con la solución hipotérmica de preservación.
La segunda fase, llamada fase de isquemia fría, es el período que transcurre desde que el órgano es preservado en un estado hipotérmico hasta su trasplante en el receptor.
Mecanismos de lesión tisular
Isquemia
El oxígeno es el combustible que controla la actividad celular al permitir la regeneración eficaz y continua del adenosintrifosfato (ATP), auténtico motor de la célula. La ausencia de flujo durante el período de isquemia precipita la aparición del ineficiente metabolismo anaerobio, que conduce a la deprivación de fosfatos de alta energía y a la acumulación de productos ácidos (incluido el ácido láctico)3.
La bomba de sodio-potasio, dependiente de ATP, queda inoperante y se pierde la regulación de los gradientes iónicos transmembrana, lo que desencadena el fracaso de las membranas celulares y la aparición de edema celular. Al perder la célula la integridad de su cubierta externa, aparecen alteraciones de la permeabilidad de la membrana celular que conducen a una pérdida del balance de los iones de sodio y calcio intracelulares, seguida de acidosis y shock osmótico3.
Los iones de sodio entran en la célula, y arrastran con ellos un volumen de agua para mantener el equilibrio osmótico con el espacio intersticial del entorno, al mismo tiempo que los iones de potasio escapan desde la célula hacia el intersticio. Estos cambios se acompañan de la activación de la fosfolipasa mitocondrial, una precipitada pérdida de fosforilación oxidativa y una ulterior disminución de la producción de ATP3.
La permeabilidad al calcio aumenta con la isquemia, lo que conlleva un incremento de calcio intracelular. Éste produce la inhibición de varias vías enzimáticas y activa la vía de las fosfolipasas. La producción subsecuente de derivados de las prostaglandinas implica la aparición de alteraciones mitocondriales y de la membrana celular. La célula acaba muriendo por necrosis3.
Lesión por reperfusión
Gran parte de la lesión de los órganos trasplantados no ocurre durante la isquemia, sino durante la reperfusión. El restablecimiento del flujo sanguíneo comporta la recuperación del aporte de oxígeno y la eliminación de los metabolitos tóxicos acumulados. Aunque la reperfusión es necesaria para recuperar el órgano después de la lesión isquémica, el vertido de estos metabolitos tóxicos a la circulación sistémica puede tener consecuencias metabólicas a distancia e inducir una ulterior lesión tisular local. Además, algunos de estos eventos pueden desencadenar procesos inflamatorios que suponen un estímulo directo para la inmunidad del receptor, lo que contribuye de forma muy significativa a la aparición del rechazo agudo del injerto4.
Por otra parte, los radicales libres de oxígeno son los mediadores más importantes de la lesión por reperfusión. Trabajos experimentales han demostrado que inmediatamente después de iniciar la reperfusión tiene lugar una liberación masiva de oxidantes que dura de 2 a 5 min4,5.
Los productos de degradación del ATP se metabolizan habitualmente convirtiéndose en urea merced a la acción de la xantina-deshidrogenasa. En el medio ácido, la xantina-deshidrogenasa se convierte en xantina-oxidasa4; la llegada de nuevo de oxígeno al entorno celular durante la fase de reperfusión hace que la xantina oxidasa convierta los productos de desecho extracelular acumulados en xantina más un anión superóxido (radical oxígeno-libre); este anión rápidamente reacciona consigo mismo para formar peróxido de hidrógeno, un potente oxidante capaz de lesionar la célula por oxidación de las membranas lipídicas y de las proteínas celulares. El peróxido de hidrógeno produce una cascada de radicales libres de oxígeno, incluidos el radical hidroxilo y el oxígeno singlete, que son incluso más potentes que los otros. Finalmente, se produce alteración de la respiración mitocondrial y peroxidación lipídica con destrucción celular6.
La producción de radicales de oxígeno también inicia la producción de prostaglandinas (mediante la activación directa de la fosfolipasa), incluido leucotrieno B4, y del factor activador de los trombocitos. Estas sustancias producen un aumento de la adherencia de los leucocitos al endotelio vascular. Estos neutrófilos pueden contribuir a la lesión local mediante el taponamiento de la microcirculación y la desgranulación que resulta en daños proteolíticos al órgano7.
La isquemia-reperfusión se asocia a la liberación marcada del factor de necrosis tumoral alfa, interferón gamma, interleucina 1 e interleucina 8. Estas citocinas causan una sobrerregulación de las moléculas de adhesión, y producen adherencia leucocitaria y tapones plaquetarios tras la revascularización, lo que resulta en fallo del injerto y rechazo del órgano8.
La capa vascular endotelial modula el tono del músculo liso del vaso mediante la liberación de varias hormonas locales o autacoides. La producción de uno de ellos, el óxido nítrico, inducida por citocinas inflamatorias, se correlaciona con la aparición de rechazo agudo9.
En la figura 1 se resumen los principales mecanismos de la lesión por isquemia-reperfusión.
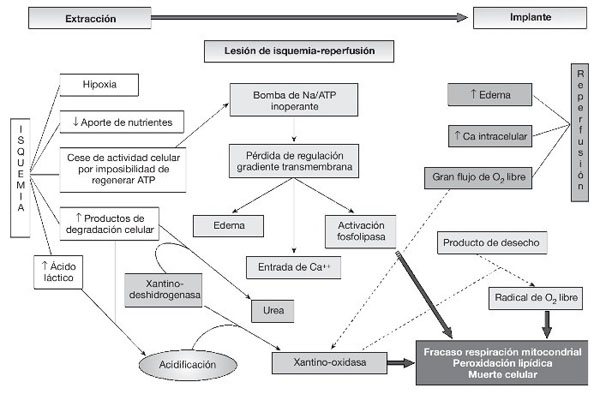
Figura 1 Fisiopatología de la lesión de isquemia-reperfusión.
Hipotermia
El fundamento de la preservación de órganos se basa en la supresión del metabolismo y de las enzimas catabólicas mediante hipotermia a 4 oC. Se ha demostrado que la hipotermia enlentece la actividad enzimática con disminución de los requerimientos de oxígeno e incluso llega a paralizarla a temperaturas inferiores a los 0 oC. Sin embargo, la congelación no ha sido útil para la preservación de órganos porque produce la formación de cristales de hielo que destruyen la célula10.
La mayoría de las enzimas en los animales normotérmicos reducen su actividad de 1,5 a 2 veces por cada 10 oC de descenso de la temperatura, pero todavía hay una importante actividad a 1 oC3,5. Por ello, el mantenimiento de unas concentraciones mínimas de ATP es fundamental para controlar las cascadas de la lesión isquémica10.
Sin embargo, la hipotermia no está exenta de efectos adversos. A su capacidad de disminuir la actividad metabólica y, por lo tanto, el consumo de ATP hay que añadir que también afecta a la actividad de la enzima Na/K ATPasa, lo que favorece el aumento del edema celular3.
Los órganos expuestos a la isquemia normotérmica permanecen viables por períodos relativamente cortos, usualmente menos de 1 h. Sin embargo, enfriando el órgano de 37 oC hasta 2-4 oC, se puede alargar el tiempo de preservación por un período de 12-13 h5. Este período de almacenamiento puede alargarse de forma significativa si, además, se utiliza una solución de preservación apropiada11.
Protección tisular y soluciones de preservación
Principios de protección tisular mediante soluciones de preservación
Para conseguir la hipotermia se realiza la infusión vascular de líquidos fríos, de manera que, además de conseguir un enfriamiento homogéneo del órgano, proporciona un lavado intravascular con arrastre de elementos formes, isoaglutininas y factores de coagulación que dificultan la microcirculación12. Estos líquidos, empleados para enfriar el órgano, han ido variando su composición, con nuevos aditivos para conferir al órgano una protección frente a los efectos de la isquemia y la hipotermia, constituyendo las diferentes soluciones de preservación.
De acuerdo con los mecanismos de lesión tisular en relación con la isquemia-reperfusión, hay una serie de principios que deben cumplir las soluciones de preservación para tratar de evitar dicha lesión12,13:
1. Minimizar el edema celular asociado a la isquemia y la hipotermia, mediante la utilización de líquidos hipertónicos (composición similar al compartimento intracelular) y la adición de sustancias impermeables para la célula, de manera que la presión osmótica de los electrolitos y las sustancias impermeabilizadoras alcance una actividad osmolar lo más parecida a la del plasma y el compartimento intracelular (en torno a los 310 mOs/kg).
2. Prevenir la acidosis intracelular asociada a la isquemia, ya que ocasiona daño celular al producir un fracaso de las membranas celulares e inducir edema celular.
3. Disminuir la entrada de calcio al interior de la célula durante la reperfusión, ya que activa las fosfolipasas que atacan la membrana celular.
4. Prevenir la expansión del espacio intersticial durante la reperfusión mediante sustancias que tengan efecto oncótico.
5. Prevenir el daño inducido por los radicales libres de oxígeno durante la reperfusión, mediante la adición de sustancias scavenger (barrendero) que frenarían el daño inducido por estos radicales.
6. Aportar precursores de ATP, ya que la reperfusión orgánica requiere la regeneración rápida de la bomba de Na que necesita ATP.
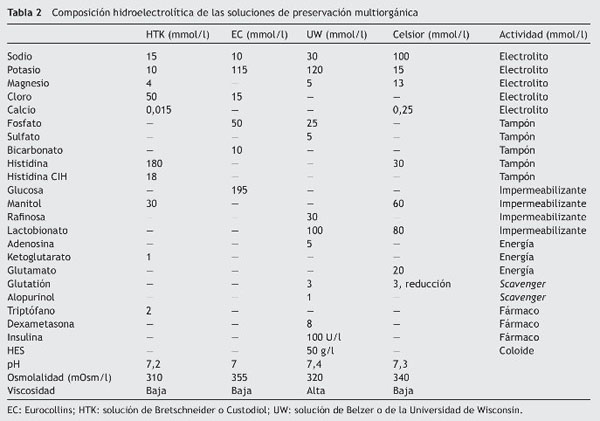
Los componentes de una solución ideal de preservación y sus diferentes funciones14 se encuentran resumidos en la tabla 1.
Soluciones de preservación y su farmacología
Son diversas las soluciones que se utilizan para la preservación de órganos12-14. Aunque cada una de ellas difiere sustancialmente en su composición, sus objetivos son los mismos: prevenir el edema celular, retrasar la destrucción celular y maximizar la función del órgano una vez que se restablezca la perfusión.
Las soluciones de preservación multiorgánica que más se utilizan en el ámbito clínico en la actualidad se presentan en la tabla 2, que resume la composición electrolítica y los diferentes componentes de dichas soluciones.
Solución de Eurocollins
Es una solución de tipo intracelular, ligeramente hiperosmótica, que se caracteriza por su sencillez y por contener altas concentraciones de potasio, fosfato que actúa como tampón, y glucosa como agente osmótico. Su uso mejoró enormemente la preservación de órganos; en el caso de la preservación renal, permitía una buena conservación de los riñones en hipotermia hasta 48 h. Esta solución es válida en la preservación de corazón, hígado y pulmón12,14.
Solución de la Universidad de Wisconsin
A principios de los años ochenta Belzer diseñó la solución de la Universidad de Wisconsin (UW) o solución de Belzer. Esta solución tiene una composición electrolítica de tipo intracelular, omite la glucosa y, además, contiene nuevos impermeabilizantes no metabolizables, como lactobionato y rafinosa. La solución también contiene fosfato y sulfato como tampones, adenosina como precursor para la resíntesis de ATP, y un coloide estable y efectivo para aportar presión coloidosmótica, el hidroxietil-almidón. Por último, se añaden otras sustancias con actividad antioxidante (glutatión, alopurinol) y citoprotectores (magnesio, dexametasona e insulina). En la actualidad, todavía se considera que es la solución de preservación de referencia para riñón, hígado, páncreas e intestino delgado13.
Custodiol o solución HTK
El Custodiol, solución HTK o solución de Bretschneider es una solución de preservación que está muy extendida en Europa central para la preservación cardíaca, renal, pancreática y hepática. Es una solución de tipo intracelular, prácticamente exenta de calcio y con concentraciones de sodio muy bajas. Como sustancias impermeabilizantes incorpora manitol e histidina. Esta última, combinada con clorhidrato de histidina, actúa como sustancia tampón. También se añade triptófano y ketoglutarato, que son protectores de la membrana celular.
El Custodiol ha mostrado su eficacia en la preservación cardíaca, ya que permite alargar la isquemia fría. En preservación renal y hepática ha mostrado resultados similares cuando se compara con la UW. A pesar de la ausencia de estudios aleatorizados y controlados, muchos grupos utilizan la solución HTK para preservar todos los órganos abdominales12,14.
Solución Celsior
La solución Celsior, diseñada en 1994, tiene una formulación de tipo extracelular que combina el efecto de los sustratos metabólicos inertes de la solución de Belzer (lactobionato, manitol) y el de actividad tampón de la solución HTK. Tiene un bajo contenido en potasio, con lo que se disminuye la hiperpotasemia tras la reperfusión del órgano, y un alto contenido en magnesio, que previene la sobrecarga celular de calcio. La histidina actúa como tampón y tiene una potente acción scavenger. Al no contener hidroxietil almidón, su viscosidad es muy baja.
En los últimos años, ha mostrado buenos resultados en preservación cardíaca, pulmonar, hepática, pancreática, renal y de intestino delgado14.
Nuevas soluciones
El interés creciente sobre la importancia de la lesión por isquemia-reperfusión en la evolución tras el trasplante ha estimulado la investigación en el campo de la lesión por preservación y el desarrollo de nuevas soluciones de preservación, como la solución de la Universidad de Ámsterdam (Polysol), la solución IGL-1, desarrollada por un grupo de Lyon o la solución de la Universidad de Kyoto13,14, que se encuentran en fase de investigación clínica.
Técnicas de preservación de órganos
Tras la extracción en el donante cadáver, el órgano debe inevitablemente ser almacenado hasta su trasplante en el receptor adecuado. Donante y receptor suelen estar en diferentes hospitales, por lo que se necesita tiempo para poder transportar el órgano entre ambos hospitales. Esto implica que sean necesarios métodos efectivos, seguros y fiables para preservar el órgano ex vivo hasta que se pueda realizar el trasplante.
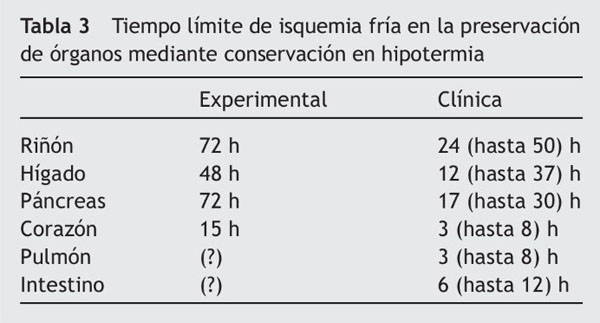
Los tiempos de preservación aceptables dependen, en primer lugar, del propio órgano. Algunos, como el corazón o el pulmón, exigen tiempos de preservación fría muy cortos, y hay que implantarlos inmediatamente después de la extracción, mientras que otros, como el riñón, pueden almacenarse con seguridad durante 40-50 h, aunque se prefiere tiempos más cortos12 (tabla 3).
Preservación hipotérmica
La hipotermia es la técnica de preferencia para la preservación de órganos. Sin embargo, la hipotermia por sí sola no es suficiente para una adecuada preservación, por lo que es necesario irrigar el órgano con soluciones especiales de preservación antes de su almacenamiento13.
Las técnicas de preservación hipotérmica más utilizadas en la actualidad son la conservación en frío y la preservación en máquina de perfusión hipotérmica.
Preservación mediante conservación en frío (CF)
El método más habitual de preservación, y también el menos costoso, es el de perfundir o lavar internamente el órgano con una solución de preservación fría inmediatamente después de la extracción en el propio quirófano. Posteriormente, se utiliza esa misma solución de preservación u otra similar para bañarlo y mantenerlo así almacenado en una nevera a 4 oC hasta el momento del implante.
Por su extremada simpleza, la CF presenta una serie de ventajas, como su disponibilidad casi universal y su facilidad de transporte, por lo que es el método de preservación más utilizado12-14.
Preservación en máquina de perfusión hipotérmica (MPH)
La preocupación de los trasplantadores por mejorar la calidad de los órganos donados, así como la necesidad de recurrir a donantes con criterios expandidos dada la escasez de órganos y la imposibilidad de valorar la viabilidad de los órganos antes del trasplante, ha impulsado en los últimos años el desarrollo de métodos de preservación mejores que el simple almacenamiento en frío13,15.
La combinación de perfusión continua y almacenamiento hipotérmico utilizada por Belzer et al16 en 1967 supuso un nuevo paradigma en la preservación de órganos, ya que consiguió preservar con éxito riñones caninos durante 72 h.
Según esta técnica, tras el lavado inicial que se realiza durante la perfusión en quirófano, el órgano es introducido en un dispositivo que mantiene un flujo controlado de forma continua o pulsátil con solución de preservación fría (0-4 oC). Este flujo permite una completa perfusión del órgano, así como limpiar de microtrombos el torrente circulatorio y facilitar la eliminación de productos metabólicos finales. Sus efectos beneficiosos son una menor incidencia de retraso en la función inicial del injerto, la posibilidad de valorar en tiempo real su viabilidad y la posibilidad de proporcionar soporte metabólico (oxígeno y sustratos) o farmacológico durante la perfusión13,15. La MPH de flujo continuo no ha demostrado ventajas con respecto a la de flujo pulsátil15.
En preservación renal, los estudios iniciales realizados con riñones de donantes en muerte encefálica no mostraron diferencias significativas en la función del injerto tras el trasplante utilizando MPH frente a CF17-19. Sin embargo, estudios posteriores demostraron que la MPH conlleva una mejor función inicial y a largo plazo del riñón trasplantado que la CF20,21 en riñones de donantes en muerte encefálica, tanto con criterios estándar como con criterios expandidos22-26. Según el Informe 2003 de la United Network for Organ Sharing (UNOS), la MPH conlleva un menor retraso en la recuperación de la función glomerular y una mejor función inmediata del injerto que la CF26 (figs. 2 y 3).
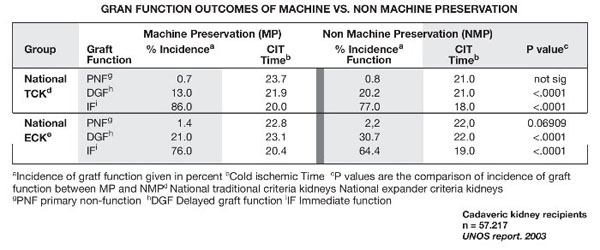
Figura 2 Análisis de la United Network for Organ Sharing de 2003 que compara la preservación
renal con y sin máquina entre donantes estándar y con criterios expandidos.
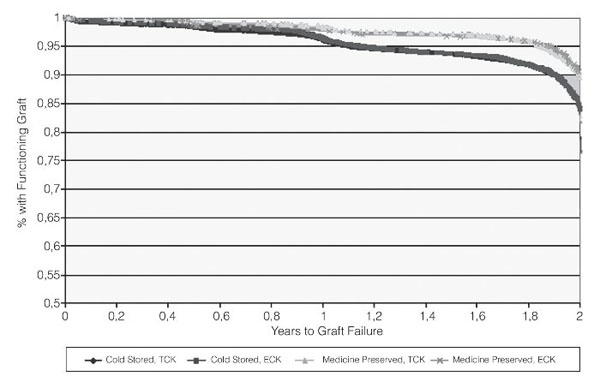
Figura 3 Riñones funcionantes y su supervivencia tras haberlos preservado o no con máquina y
según provengan o no del grupo de donantes con criterios expandidos (UNOS, 2003).
Los beneficios de la MPH son más claramente visibles en la preservación de los riñones de donantes a corazón parado, en los que hay un daño importante derivado de la isquemia caliente. Hay datos convincentes de que la MPH es mejor que la CF27-34; los riñones preservados en máquina muestran mejor función inicial de injerto, disminución de las necesidades de hemodiálisis y mayor supervivencia del injerto a largo plazo que los almacenados en frío28,29,35,36. Un metaanálisis de los estudios publicados entre 1971 y 2001 puso de manifiesto una disminución en el retraso de la función renal tras el trasplante (20%), un inicio en el descenso de la creatinina más precoz y una mejor supervivencia del injerto al año cuando se utiliza la MPH37.
A pesar de la evidencia de que las técnicas de preservación con máquina proporcionan una mayor calidad del injerto y mayores tiempos de preservación, la técnica estándar actual es la perfusión del órgano con una solución de preservación y su almacenamiento a 4 oC durante el mínimo tiempo necesario antes del trasplante. Un argumento válido a favor de esta práctica es que proporciona aceptables resultados con un método más simple y barato que la máquina de perfusión, que requiere un instrumental caro e incómodo, así como personal adicional para hacerlo funcionar15.
Una importante limitación de la preservación de órganos mediante la CF es la imposibilidad de valorar si el órgano funcionará adecuadamente tras el trasplante. En este sentido, la perfusión con máquina ofrece una serie de ventajas añadidas con respecto a la preservación mediante enfriamiento simple, como: a) reducir las resistencias vasculares inducidas por la isquemia y facilitar la eliminación de los restos de eritrocitos de la microcirculación, lo que permite una mejor reperfusión tras el implante38, y b) la posibilidad de comprobar la viabilidad o la calidad del órgano antes de su implante, mediante la monitorización del flujo y la presión39 o la determinación de marcadores bioquímicos liberados por el riñón y presentes en líquido de preservación que se relacionan con la viabilidad renal (alfa-glutatión-S-transferasa, pi-glutatión-S-transferasa, alaninaminopeptidasa, etc.)40,41.
El líquido más ampliamente utilizado en la MPH es el de Wisconsin modificado, ya que como impermeabilizante se utiliza el gluconato en lugar del ácido lactobiónico, que no es efectivo42. Otras soluciones de más reciente aparición no aportan mejoras significativas en la preservación renal22.
La preservación con MPH se utiliza clínicamente casi de forma exclusiva para el riñón y en muy pocos centros. En Europa no está muy extendido su uso, pero en Estados Unidos se utiliza de forma mantenida en un 20% de los centros de trasplante renal13 (fig. 4). La figura 5 muestra dos modelos actuales de MPH pulsátil utilizados para preservación renal.

Figura 4 Cantidad relativa de máquinas de perfusión renal y preservación mediante conservación
en frío en Estados Unidos en el período 1988-2005 (datos procedentes de Organ Procurement
and Transplantation Network, octubre de 2006). Tomado de Maathuis et al13.

Figura 5 Dos modelos diferentes de máquinas de perfusión continua y flujo pulsátil para preservación
renal. A: modelo Waters RM3® Renal Preservation System de Waters Medical System®. B: modelo
Life Port Kidney Transporter® de Organ-Recovery Systems®.
La experiencia en preservación hepática con MPH es muy escasa; se limita casi exclusivamente a trasplante hepático experimental donde se han conseguido preservaciones con éxito de 72 h43. Recientemente se ha publicado un artículo con los resultados de su aplicación clínica que indican una mejora de la preservación hepática44.
Preservación normotérmica
Recientemente, algunos grupos han mostrado su interés sobre los efectos beneficiosos de la perfusión continua normotérmica o subnormotérmica (25-37 oC) en la preservación, sobre todo de órganos procedentes de donantes a corazón parado13,45,46. Los potenciales beneficios de la nomotermia durante la perfusión son la disminución de las resistencias vasculares y el aumento de la liberación de oxígeno15.
Aspectos clínicos de la preservación de órganos
Riñón
Aunque hay un importante debate, hay dos métodos de preservación renal aplicables en el ámbito clínico: a) la conservación en frío, que sería efectiva para riñones recuperados de donantes óptimos, y b) la máquina de perfusión hipotérmica pulsátil que estaría indicada para la preservación de riñones que hayan sufrido daños por isquemia caliente o hipotensión12-14. Las soluciones de preservación más utilizadas son Eurocollins, Wisconsin y Custodiol, que obtienen unos tiempos de preservación que oscilan en 18-36 h47.
Hígado
La preservación hepática es más crítica que la renal ya que, al no disponerse de máquina sustitutiva del órgano, es obligado que las funciones del injerto retornen inmediatamente después del trasplante. En el ámbito clínico el método de preservación utilizado es la CF. La técnica de preservación y perfusión consiste en la irrigación vascular a través de la arteria hepática (unos 2.000 ml de solución) y por la vena porta de forma accesoria (unos 1.000 ml).
Se admiten tiempos de preservación de 12 a 18 h, aunque se han comunicado48 casos con períodos de hasta 30 h. Sin embargo, parece claro que períodos mayores de 12 h conllevan una alta incidencia de complicaciones biliares48.
Tradicionalmente, la solución de preservación más utilizada ha sido la UW, aunque soluciones más recientes, como la Celsior y la HTK, están emergiendo con resultados prometedores, incluso con una mayor protección de las complicaciones biliares48-50. Probablemente, en la actualidad, la HTK sea la solución de preservación más utilizada para el trasplante de órganos abdominales12,14.
Como hemos comentado, la utilización de la MPH es muy escasa, y se limita casi exclusivamente a trasplante hepático experimental.
Páncreas
El trasplante de páncreas como órgano puede ser total o segmentario; el procedimiento de preservación es el mismo que para el riñón, ya que en más del 90% de las ocasiones se realiza trasplante combinado, páncreas-riñón12.
La mayoría de los equipos prefieren la solución de Wisconsin como medio de preservación51. La extracción se realiza junto con el hígado, que se irriga con solución de UW (250-500 ml) a través de la arteria mesentérica superior y la esplénica. El tiempo de preservación puede ser de 12-18 h, aunque se han comunicado períodos de hasta 30 h48. Se preserva con almacenamiento hipotérmico simple.
Diferentes estudios han mostrado que la HTK obtiene similares resultados que la UW, tanto en la función inicial del injerto como en el índice de complicaciones52.
Corazón
La preservación cardíaca ha cambiado poco en los últimos años. La solución cristaloide hiperpotasémica (cardioplejía) se utiliza a 4 oC, y 4 h es el límite aceptado de isquemia fría, aunque investigaciones clínicas aisladas muestran que este tiempo puede extenderse a 8 h o más con el uso de las nuevas soluciones de preservación53. Otras soluciones de preservación utilizadas con buenos resultados son la del Hospital de St Thomas, la UW y la Celsior54,55.
El método más común es el almacenamiento hipotérmico con la suplementación de cardioplejía a través de las arterias coronarias en el momento del paro, durante el almacenamiento e intermitentemente en el trasplante53.
Pulmón
La preservación de la función pulmonar requiere unas condiciones muy precisas56. El límite máximo de isquemia para los pulmones no ha sido definido aún, pero se ha tomado las 6 h como el período límite empírico14. La técnica más utilizada es la perfusión simple del pulmón con una solución de preservación a través de la arteria pulmonar. Con respecto a cuál es la mejor solución aún no ha sido determinado. Aunque la solución de EC es la más utilizada, algunos trabajos muestran mejores resultados con la UW. Recientemente, la utilización de soluciones bajas en K (Celsior, Perfadex) ha demostrado resultados similares a la UW y superiores a EC57,58.
Intestino delgado
El intestino se preserva usualmente con la solución UW, aunque la HTK y la Celsior han mostrado también buenos resultados. Dado que la mayoría de las extracciones de intestino delgado se llevan a cabo en donantes multiorgánicos, la técnica de preservación que se utiliza es la estándar intraaórtica. El tiempo de isquemia fría del intestino es aproximadamente de 12 h59.
Bibliografía
1. Daga D, Fernández C, Segura F, Carballo M. Indicaciones y resultados a largo plazo de los trasplantes de órganos sólidos. Calidad de vida en pacientes trasplantados. Med Intensiva. 2008;32:296-303. [ Links ]
2. International figures on organ donation and transplantation 2007. Transplant Newsletter. 2008;13:1-14. [ Links ]
3. Belzer FO, Southard JH. Organ preservation. Annu Rev Med. 1995;46:235-47. [ Links ]
4. Koyama I, Bulkley GB, Williams GM, Im MJ. The role of oxygen free radicals in mediating the reperfusion injury of cold-preserved ischemic kidneys. Transplantation. 1985;40:590-5. [ Links ]
5. Clavien PA, Harvey PR, Strasberg SM. Preservation and reperfusion injuries in liver allografts. An overview and synthesis of current studies. Transplantation. 1992;53:957-78. [ Links ]
6. Schachter M, Foulds S. Free radicals and the xantina oxidase pathway. En: Grace PA, Mathie RT, editores. Ischaemia-reper-fusion injury. London: Blackwell Science; 1999. p. 137-56. [ Links ]
7. Hansen PR. Role of neutrophils in myocardial ischemia and reperfusión. Circulation. 1995;91:1872-5. [ Links ]
8. Colletti LM, Burtch GD, Remick DG, Kunkel SL, Strieter RM, Guice KS. The production of tumor necrosis factor alpha and the development of a pulmonary capillary injury following hepatic ischemia/reperfusion. Transplantation. 1990;49:268-72. [ Links ]
9. Strüber M, Harringer W, Ernst M, Morschheuser T, Hein M, Bund M. Inhaled nitric oxide as a prophylactic treatment against reperfusion injury of the lung. Thorac Cardiovasc Surg. 1999;47: 179-82. [ Links ]
10. Southard JH, Senzig KA, Belzer FO. Effects of hypothermia on canine kidney mitochondria. Cryobiology. 1980;17:148-53. [ Links ]
11. Collins GM, Bravo-Shugarman M, Terasaki PI. Kidney preservation for transportation. Initial perfusion and 30 hours' ice storage. Lancet. 1969;2:1219-22. [ Links ]
12. Torras J, Grinyó JM. Líquidos y técnicas de preservación de órganos. En: Valero R, Páez G, editores. Manual de coordinación de trasplantes. Barcelona: TPM-Les Heures-Universitat de Barcelona; 2005. p. 185-202. [ Links ]
13. Maathuis MHJ, Leuvenink HGD, Ploeg RJ. Perspectives in organ preservation. Transplantation. 2007;83:1289-98. [ Links ]
14. Sanjee K, Arenas JD. Organ preservation. e-Medicine web page. Geibel J, editor [actualizado 15 Ene 2008]. Disponible en: http://www.emedicine.com/med/topic3505.htm. [ Links ]
15. St Peter SD, Imber CJ, Friend PJ. Liver and kidney preservation by perfusion. Lancet. 2002;359:604-13. [ Links ]
16. Belzer FO, Ashby BS, Dunphy JE. 24-hour and 72-hour preservation of canine kidneys. Lancet. 1967;2: 536-8. [ Links ]
17. Opelz G, Terasaki PI. Advantage of cold storage over machine perfusion for preservation of cadaver kidneys. Transplantation. 1982;33:64-8. [ Links ]
18. Van der Viet JA, Vroemen AM, Koostra G. Comparison of cadaver kidney preservation methods in Eurotransplant. Transplant Proc. 1984;16:180-1. [ Links ]
19. Mozes MF, Finch WT, Reckard FK, Merkel, Cohen C. Comparison of cold storage and machine perfusion in the preservation of cadaver kidneys: a prospective randomized study Transplant Proc. 1985;17:1474-7. [ Links ]
20. Haloran P, Aprile M. A randomized prospective trial of cold storage versus pulsatile perfusion for cadaver kidney preservation. Transplantation. 1987;43:827-32. [ Links ]
21. Polyak MM, Arrington BO, Stubenbord W, Boykin J, Brown T, Jean-Jaques M, et al. The influence of pulsatile preservation on renal transplantation in the 1990s. Transplantation. 2000;69: 249-70. [ Links ]
22. Baicu SC, Taylor MJ, Brockbank KGM. The role of perfusion solution on acid- base regulation during machine perfusion of kidneys. Clin Transplant. 2005;20:113-21. [ Links ]
23. Nyberg SL, Baskin-Bey ES, Kremers W, Prieto M, Henry ML, Ste-gall MD. Improving the prediction of donor kidney quality: deceased donor score and resistive indices. Transplantation. 2005;80:925-9. [ Links ]
24. Baskin-Bey ES, Kremers W, Stegall MD, Nyberg SL. United Network for Organ Sharing's expanded criteria donors: is stratification useful? Clin Transplantation. 2005;19:406-11. [ Links ]
25. Mozes MF, Skolek RB, Korf BC. Use of perfusion parameters in predicting outcomes of machine - preserved kidneys. Transplant Proc. 2005;37: 350-1. [ Links ]
26. UNOS 2003 Annual Reprt of US. Organ Procurement and Transplantation Network and the Scientific Registry of Transplant Recipients Transplant Data 2003. Disponible en: www.unos.org. [ Links ]
27. Kozaki K, Sakurai E, Tamaki I, Matsuno N, Saito A, Furuhaski K, et al. Usefulness of continuous hypothemic perfusion preservation for cadaveric renal grafts in poor condition. Transplant Proc. 1995;27:757-8. [ Links ]
28. Daemen JH, De Vries B, Kootstra G. The effect of machine perfusión preservation on early function of non-heart-beating donors. Transplant Proc. 1997;29:3489. [ Links ]
29. Matsumo N, Sakurai E, Uchiyama M, Kozaki K, Miyamoto K, Kozaki M. Usefulnes of machine perfusion preservation for non-heart-beating-donors in kidney transplantation. Transplant Proc. 1996;28:1551-2. [ Links ]
30. Matsumo N, Sakurai E, Tamaki I, Uchiyama M, Kozaki K, Kozaki M. The effect of machine perfusion preservation versus cold storage on the function of kidneys from non-heart-beating-donors. Transplant Proc. 1994;27:293-4. [ Links ]
31. Szust J, Olson L, Cravero L. A comparison of OPO pulsatile machine preservation practices and results. J Transpl Coord. 1999;9:97-100. [ Links ]
32. Del Río F, Núñez JR, Soria A, Moreno MA, Varela A, Calatayud J. Non heart beating donors. Succesfully expanding the donor's pool. Ann Transp. 2004;9:19-20. [ Links ]
33. Sánchez-Fructuoso AI, Marques M, Del Río F, Núñez JR, Barrientos A. Victims of cardiac arrest occurring outside the hospital: a source of transplantable kidneys. Ann Intern Med. 2006;145: 157-64. [ Links ]
34. Del Río F, Núñez JR. Donación de órganos a corazón parado. En: Matesanz R, editor. El modelo español de coordinación y trasplantes. Madrid: Aula Médica; 2008. p. 135-47. [ Links ]
35. Tanabe K, Oshima T, Tokumoto T, Ishikawa N, Kanematsu A, Shinmura H, et al. Long term renal function in non-heart-beating donor hidney transplantation: a single center experience. Transplantation. 1998;66:1708-13. [ Links ]
36. Balupuri S, Strong A, Hoernich N, Snowden C, Mohamed M, Manas D, et al. Machine perfusion for kidneys: how to do it a minimal cost. Transpl Int. 2001;14:103-7. [ Links ]
37. Wight JP, Chilcott JB, Holmes MW, Brewer N. Pulsatile machine perfusion vs cold storage of kidneys for transplantation: a rapid systematic review. Clin Transplant. 2003;17: 293-307. [ Links ]
38. Booster MH, Wijnen RMH, Yin M, Tiebosch AT, Heineman E, Maessen JG, et al. Enhanced resistance to the effect of normothermic isquemia in kidneys using pulsatile machine perfusion. Transplant Proc. 1993;25:3006-11. [ Links ]
39. Matsuno N, Konno O, Mejit A, Jyojima Y, Akashi I, Nakamura Y, et al. Application of machine perfusión preservation as a viability test for marginal kidney graft. Transplantation. 2006;82: 1425-8. [ Links ]
40. Van Kreel BK, Janssen MA, Koostra G. Functional relationship of alpha-glutatione-S-transferasa and glutathione-S-transferasa activity in machine-preserved non-heart-beating-donor kidneys. Transpl Int. 2002;15:546-9. [ Links ]
41. Hasman D, Treska V, Kuntscher V, Hes O, Trefil V, Reischig T, et al. Multiple monitoring of non-heart-beating donor kidneys during pulsatile perfusion. Organs and Tissues. 2004;1:11-4. [ Links ]
42. McAnulty JF, Vreugdenhil PK, Southard JH, Belzer FO. Use of UW cold storage solution for machine perfusion of kidneys. Transplant Proc. 1990;22:458-9. [ Links ]
43. Schreinemachers MC, Doorschodt BM, Van Gulik TM. Machine perfusion preservation of the liver: a worthwhile clinical activity. Curr Opin Organ Transplant. 2007;12:224-30. [ Links ]
44. Guarrera JV, Estevez J, Boykin J, Boyce R, Rashid J, Sun S, et al. Hypothermic machine perfusion of liver grafts for transplantation: Technical development in human discard and miniature swine models. Transplant Proc. 2005;37:323-5. [ Links ]
45. Valero R, Cabrer C, Oppenheimer F, Trias E, Sanchez-Ibañez J, De Cabo, et al. Normothermic recirculation reduces primary graft dysfunction of kidneys obtained from nonheart-beating donors. Transpl Int. 2000;13:303-10. [ Links ]
46. St Peter SD, Imber CJ, Lopez I, Hughes D, Friend PJ. Extended preservation of non-heart-beating donor livers with normothermic machine perfusion. Br J Surg. 2002;89:609-16. [ Links ]
47. Badet L, Eugène M, Hauet T, Barrou B. The use of preservation solutions in renal transplantation. Prog Urol. 2006;16:25-31. [ Links ]
48. Cavallari A, Cillo U, Nardo B, Filipponi F, Gringeri E, Montalti R. A multicenter pilot prospective study comparing Celsior and University of Wisconsin preserving solutions for use in liver transplantation. Liver Transp. 2003;9:814-21. [ Links ]
49. Feng L, Zhao N, Yao X, Sun X, Du L, Diao X, et al. Histidinetryptophan-ketoglutarate solution vs. University of Wisconsin solution for liver transplantation: a systematic review. Liver Transplant. 2007;13:1125-36. [ Links ]
50. Pedotti P, Cardillo M, Rigotti P, Gerunda G, Merenda R, Cillo U. A comparative prospective study of two available solutions for kidney and liver preservation. Transplantation. 2004;77: 1540-5. [ Links ]
51. Boggi U, Vistoli F, Del Chiaro M, Signori S, Croce C, Pietrabissa A. Pancreas preservation with University of Wisconsin and Celsior solutions: a single-center, prospective, randomized pilot study. Transplantation. 2004;77:1186-90. [ Links ]
52. Englesbe MJ, Moyer A, Kim DY, Granger DK, Pietroski R, Yoshida A, et al. Early pancreas transplant outcomes with histidinetryptophan-ketoglutarate preservation: a multicenter study. Transplantation. 2006;82:136-9. [ Links ]
53. Michel P, Vial R, Rodriguez C, Ferrera R. A comparative study of the most widely used solutions for cardiac graft preservation during hypothermia. J Heart Lung Transplant. 2002;21: 1030-9. [ Links ]
54. Desrois M, Caus T, Lan C, Sciaky M, Cozzone PJ, Bernard M. Comparative effects of Celsior and a new cardioplegic solution on function, energy metabolism, and intracellular pH during long-term heart preservation. Transplant Proc. 2002;34:1259-61. [ Links ]
55. Remadi JP, Baron O, Roussel JC, Al Habash O, Treilhaud M, Despins P. Myocardial preservation using Celsior solution in cardiac transplantation: early results and 5-year follow-up of a multi-center prospective study of 70 cardiac transplantations. Ann Thorac Surg. 2002;73:1495-9. [ Links ]
56. Del Río F, Escudero D, De la Calle B, Gordo Vidal F, Valentín Paredes M, Núñez JR. Evaluación y mantenimiento del donante pulmonar. Med Intensiva. 2009;33:40-9. [ Links ]
57. Padilla AM, Padilla JD. Estado actual de la preservación pulmonar. Arch Bronconeumol. 2004;40:86-93. [ Links ]
58. Ganesh JS, Rogers CA, Banner NR, Bonser RS, Steering Group of the UK Cardiothoracic Transplant Audit. Does the method of lung preservation influence outcome after transplantation? An analysis of 681 consecutive procedures. J Thorac Cardiovasc Surg. 2007;134:1313-21. [ Links ]
59. Gondolesi G, Fauda M. Technical refinements in small bowel transplantation. Curr Opin Organ Transplant. 2008;13: 259-65. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: joseluis.escalante@salud.madrid.org
(J.L. Escalante Cobo).
Recibido el 11 de diciembre de 2008;
Aceptado el 7 de enero de 2009